Aquest avanç permetrà dissenyar tractaments personalitzats i més efectius, i testar futurs fàrmacs d’una manera molt més eficient.

La distròfia miotònica és una malaltia neuromuscular degenerativa hereditària que es manifesta principalment en adults, afectant unes 50.000 persones a Espanya. Els símptomes varien des de dificultat per caminar fins a greus problemes neurològics, i condueixen a una incapacitació progressiva que per desgràcia porta a la cadira de rodes a molts dels afectats. Aquesta malaltia és molt heterogènia entre pacients (edat d’inici, progressió, transmissió hereditària, músculs afectats) el que fa especialment complex el desenvolupament de tractaments genèrics.
Actualment, els fàrmacs contra la distròfia miotònica es desenvolupen en models animals com la Drosophila, la mosca del vinagre, o en cultius cel·lulars en 2D. Més tard es proven en ratolins i, finalment en pacients. Utilitzant aquests enfocaments s’han desenvolupat alguns fàrmacs que desafortunadament no han pogut arribar a les últimes fases d’assajos clínics perquè no eren efectius en pacients, posant de manifest la dificultat d’extrapolar resultats obtinguts amb animals a éssers humans.
Ara, l’equip liderat pel Professor d’Investigació ICREA i cap del grup Biosensors per Bioenginyeria a l’IBEC, Javier Ramón, i per l’investigador postdoctoral del seu equip Juan M. Fernández, ha desenvolupat per primera vegada un model tridimensional per a la distròfia miotònica, utilitzant tècniques de bioenginyeria i cèl·lules de pacient. El treball, que forma part de la tesi doctoral de la investigadora Xiomara Fernández de l’IBEC i s’ha realitzat en col·laboració amb investigadors de l’institut de recerca sanitària INCLIVA de València, s’ha publicat recentment a la revista Biofabrication i obre les portes a trobar tractaments personalitzats i efectius contra aquesta malaltia rara i fins ara sense cura. Aquest treball s’ha finançat en part amb fons d’una campanya de recaptació de fons llançada per l’IBEC des de finals de 2017 fins a finals de l’2019.
El nou model 3D per a la distròfia miotònica
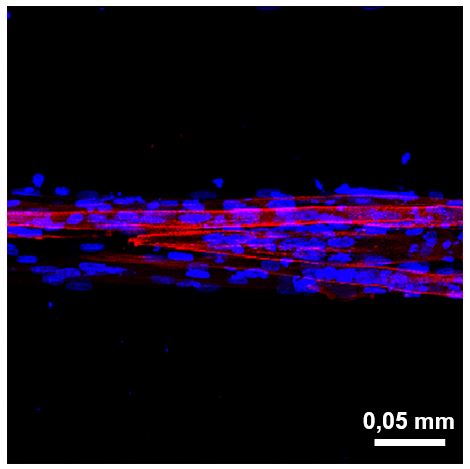
Els investigadors han partit de fibroblasts de la pell d’un pacient, cèl·lules del teixit connectiu encarregat de mantenir la seva estructura, que van ser prèviament “reprogramats” perquè es convertissin en mioblasts, cèl·lules precursores del múscul. Aquests mioblasts es van posar dins d’una matriu de gelatina i cel·lulosa i la barreja es va sotmetre a una mena de segell de goma per donar-li una forma de rectangles allargats, simulant les fibres musculars. Posteriorment la matriu es va incubar sota les condicions ideals perquè els mioblasts seguissin el seu desenvolupament.
Imatge: Imatge de microscòpia confocal de múscul in vitro desenvolupat a partir de cèl·lules de pacient en què s’aprecia la tridimensionalitat de la roba. En blau es marquen els nuclis cel·lulars i en vermell el múscul esquelètic.
El que observem és que, a diferència dels cultius cel·lulars clàssics, les cèl·lules de pacient en el nostre model són capaces de fusionar-se formant fibres musculars que adopten la forma 3D observada en els músculs i essencial per al seu funcionament.
Juan M. Fernandez
Possibilitat de provar fàrmacs de forma personalitzada i ràpida
Per avaluar la funcionalitat del nou model 3D, els investigadors han aplicat a les fibres musculars un fàrmac, AntagomiR-23b, prèviament desenvolupat per alguns autors d’aquest treball, i que en un futur no molt llunyà entrarà en fase d’assajos clínics a través de l’empresa Arthex Biotech que continua el progrés de la teràpia. Van observar que tant les característiques moleculars com estructurals de les fibres derivades del pacient van recuperar els seus paràmetres normals desprès del tractament, validant la seva utilització per al desenvolupament de nous fàrmacs.
A més, aquest model té un cost reduït, la seva implementació és simple i pot accelerar el procés de desenvolupament de nous tractaments, ja que és més ràpid comparat amb l’ús d’animals. Representa un gran pas cap a la medicina personalitzada, ja que tenir en compte l’enorme variabilitat entre pacients és clau en el moment de buscar tractaments per aquesta malaltia.
Aquest nou model permetrà provar diferents fàrmacs i administrar al pacient el que ha donat millor resultat amb les seves pròpies cèl·lules. D’aquesta manera el tractament serà personalitzat, més efectiu i a més es prescindeix de l’ús d’animals.
Xiomara Fernandez
La distròfia miotònica
La malaltia és causada per una mutació en el gen DMPK (Dystrophia Myotonica Protein Kinase) que causa el “segrest” de proteïnes essencials per al correcte funcionament dels músculs, especialment les proteïnes “Muscleblind“. Al reduir la seva disponibilitat no pot realitzar normalment les seves funcions, entre elles fer la transició d’altres proteïnes d’una fase fetal o infantil a una fase adulta. La conseqüència és que els pacients tenen proteïnes que no funcionen com les d’un adult. Dos exemples són el receptor d’insulina, que en pacients de distròfia miotònica no funciona correctament i causa diabetis, i la proteïna que regula l’entrada i sortida de clor de les cèl·lules musculars, els coneguts com a canals de clor. El seu mal funcionament és la causa de la miotonia, el símptoma que defineix la malaltia i que fa que els pacients puguin contraure el múscul, però tinguin molta dificultat per relaxar-lo.
Article de referència: Xiomara Fernández-Garibay, María A. Ortega, Estefanía Cerro-Herreros, Jordi Comelles, Elena Martínez, Rubén Artero, Juan M. Fernández-Costa and Javier Ramon. Bioengineered in vitro 3D model of myotonic dystrophy type 1 human skeletal muscle. Biofabrication (2021), 13 (3), 035035.





