About
We aim at understanding how physical forces and molecular control modules cooperate to drive biological function.
We develop new technologies to map and perturb the main physical properties that determine how cells and tissues grow, move, invade and remodel.
By combining this physical information with systematic molecular perturbations and computational models we explore the principles that govern the interplay between chemical and physical cues in living tissues.
We study how these principles are regulated in physiology and development, and how they are derailed in cancer and aging.
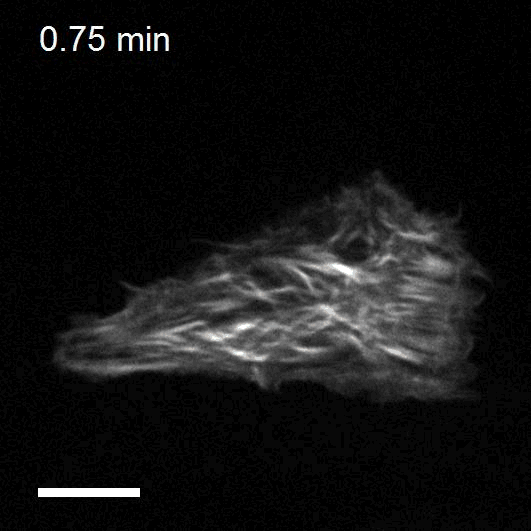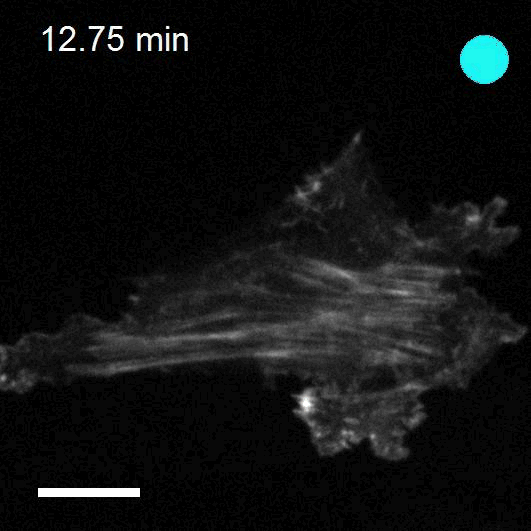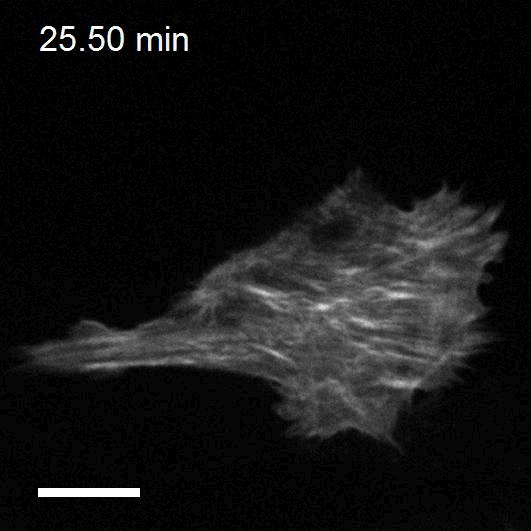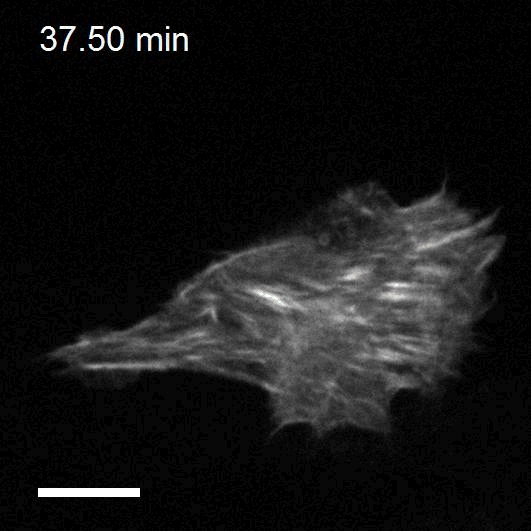
Making cellular forces visible
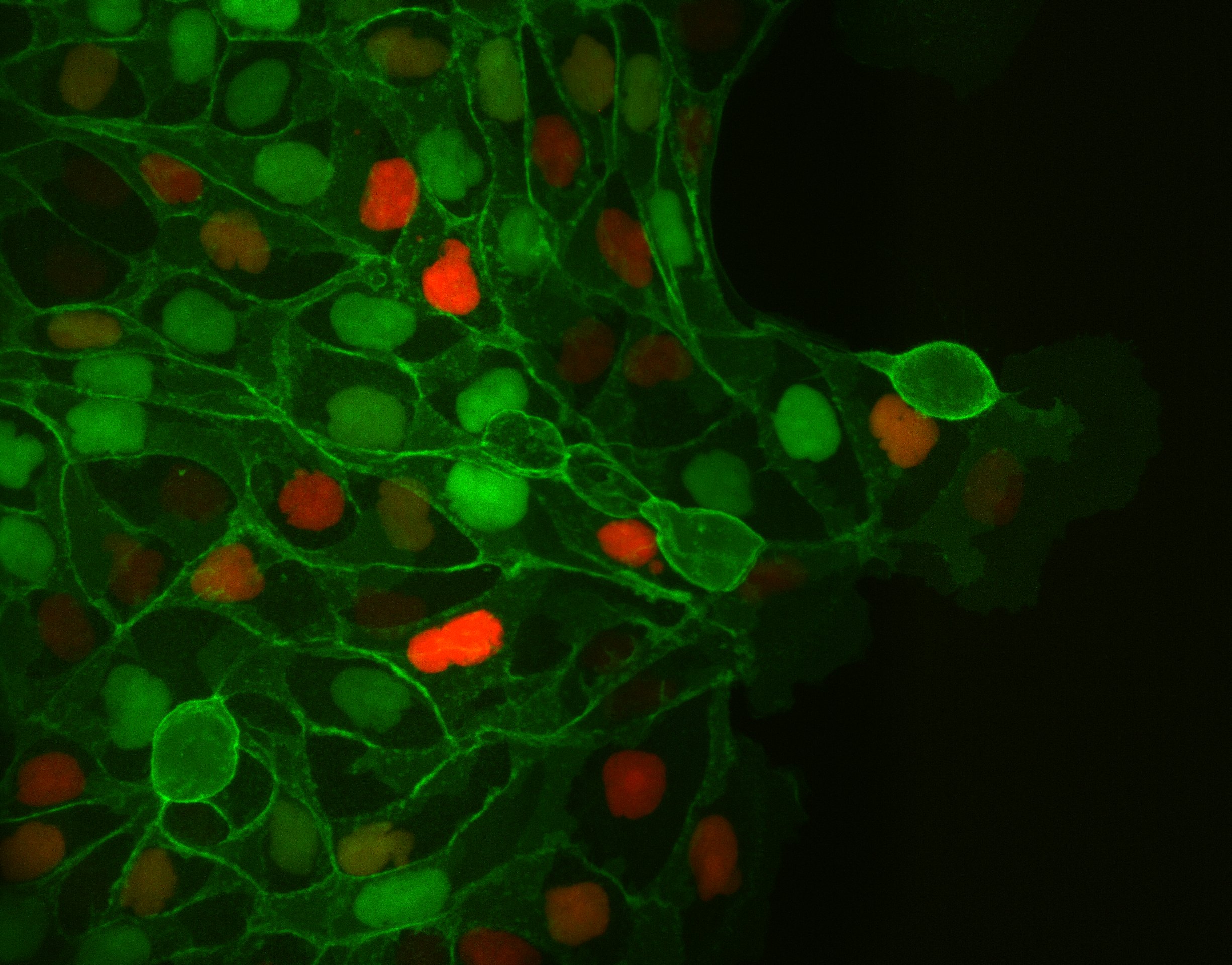
To study cell and tissue dynamics we develop new technologies to measure physical forces at the cell-cell and cell-matrix interface. By combining these technologies with computational analysis of cell shape and velocity we obtain a full experimental characterization of epithelial dynamics during tissue growth, wound healing and cancer cell invasion.
Tumour invasion by stromal forces
Cancer cell invasion and metastasis remain the leading cause of death in patients with cancer. Both processes are the result of a complex interaction between tumor cells and their microenvironment. One of our main lines of research is to study how tumours exploit the functions of non-cancer cells in their microenvironment to invade and metastasize. We focus on the interaction between epithelial cancer cells and Cancer Associated Fibroblasts (CAFs), the most abundant cell type in the tumour stroma.
Optogenetics to control cell mechanics
The recent development of optogenetic technologies offers promising possibilities to control signalling pathways with high spatiotemporal resolution. By expressing genetically encoded light-sensitive proteins, optogenetic technology enables the reversible perturbation of intracellular biochemistry with subcellular resolution. We have developed optogenetic tools based on controlling the activity of endogenous RhoA to upregulate or downregulate cell contractility and to control cell shape and mechanotransduction.
Collective durotaxis: a mechanism for cellular guidance by mechanical cues
Directed cell migration is one of the earliest observations in cell biology, dating back to the late XIX century. Also known as taxis, directed cell migration has been commonly associated with chemotaxis, i.e. the ability of a broad variety of cell types to migrate following gradients of chemical factors. We recently demonstrated a new mode of collective cell guidance by mechanical cues, called collective durotaxis. This new migration mode emerges only in cell collectives and, strikingly, does not require isolated cells to exhibit gradient sensing.
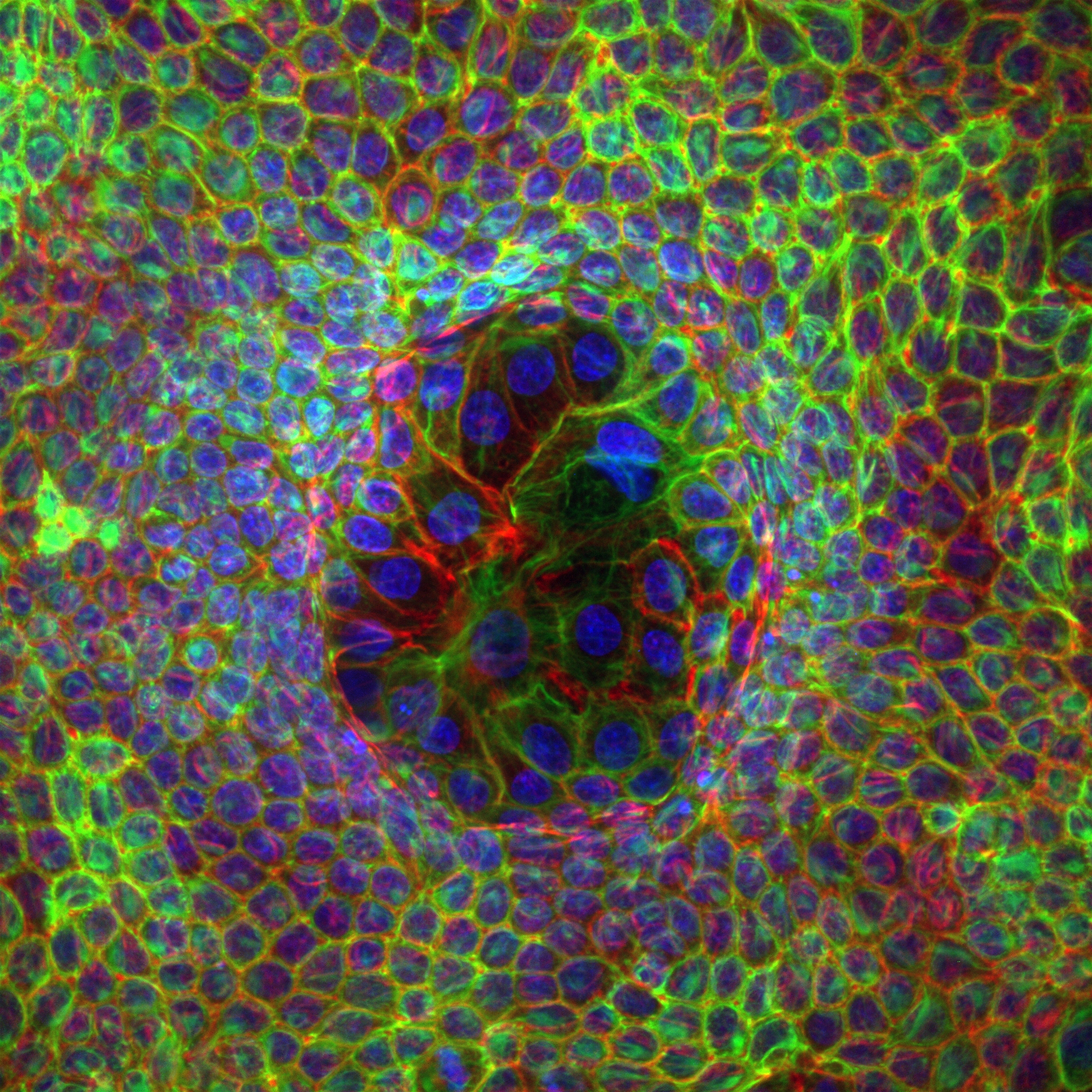
Organoid mechanobiology
Organoids are large multicellular structures that self-organize in vitro and maintain a similar organization and functionality than the organ from which they are derived. Organoids from many organs have now been obtained from embryonic stem cells, induced pluripotent stem cells and organ progenitors. We use intestinal and kidney organoids to study how epithelia adopt three-dimensional shapes that closely resemble their structure in vivo. We also use organoids grown from primary tumors to understand how epithelial structure and function are lost with disease progression.
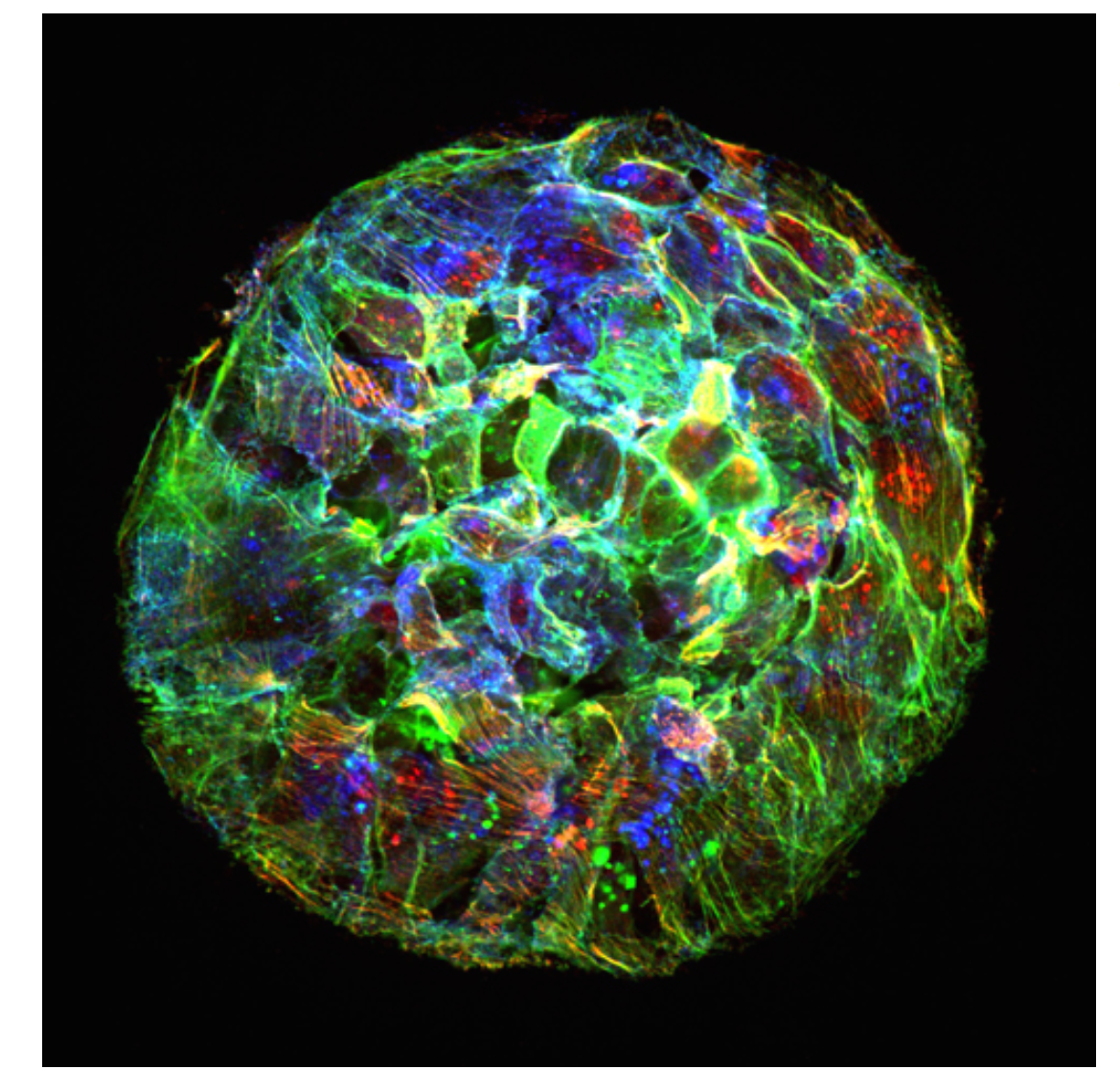
Engineering epithelial shape and mechanics from the bottom up
We develop new approaches to engineer epithelia in 3D. Using these approaches, we study the principles that govern the emergence of tissue shape from the bottom up. We recently found that epithelial sheets can stretch up to four times their initial area without breaking, and that they are able to recover their initial size in a fully reversible way when unstretched. Surprisingly, some cells in the tissue barely stretch, while others become ‘superstretched’, increasing their area more than ten times. We call this phenomenon ‘active superelasticity’.
Staff
Xavier Trepat
Projects
| NATIONAL PROJECTS | FINANCER | PI |
|---|---|---|
| mGRADIENTMecanobiología de la migración colectiva durante la haptotaxis y la durotaxis: aplicación a los organoides intestinales (2019-2022) | MICIU Generación Conocimiento: Proyectos I+D | Xavier Trepat |
| DYNAGELHidrogeles biocompatibles con rigidez dinámicamente ajustable para estudiar la mecanobiología de células y tejidos (2019-2022) | MICIU Retos investigación: Proyectos I+D | Raimon Sunyer |
| INTERNATIONAL PROJECTS | FINANCER | PI |
|---|---|---|
| EpiFold Engineering epithelial shape and mechanics: from synthetic morphogenesis to biohybrid devices (2021-2025) | European Commission, ERC-AdG | Xavier Trepat |
| The role of intermediate filaments in stress resistance in 3D epithelial structures (2021-2023) | Deutsche Forschungsgemeinschaft (DFG), Walter Benjamin-Programme | Tom Golde |
| Mechano·Control Mechanical control of biological function (2017-2022) | European Commission, FET Proactive | Xavier Trepat |
| Control of cell collective flows and tissue folding by means of surface patterns (2021-2022) | Human Frontier Science Program, HFSP Beca postdoctoral | Pau Guillamat |
| PRIVATELY-FUNDED PROJECTS | FINANCER | PI |
|---|---|---|
| Mech4Cancer · Enabling technologies to map nuclear mechanosensing: from organoids to tumors (2020-2023) | Obra Social La Caixa: Health Research Call | Xavier Trepat |
| T cell exclusion during cancer immune evasion and immunotherapy failure: cell types, transcriptional programs and biomechanics (2020-2023) | Fundació La Marató de TV3 | Xavier Trepat |
| Joint Programme Healthy Ageing | Obra Social La Caixa | Xavier Trepat |
| Understanding and measuring mechanical tumor properties to improve cancer diagnosis, treatment, and survival: Application to liquid biopsies (2017-2022) | Obra Social La Caixa | Xavier Trepat |
| FINISHED PROJECTS | FINANCER | PI |
|---|---|---|
| OPTOLEADER Optogenetic control of leader cell mechanobiology during collective cell migration (2019-2021) | European Commission, MARIE CURIE – IF | Leone Rossetti |
| MECHANOIDS Probing and controlling the three-dimensional organoid mechanobiology (2019-2021) | European Commission, MARIE CURIE – IF | Manuel Gómez |
| TensionControl Multiscale regulation of epithelial tension (2015-2020) | European Commission, ERC – CoG | Xavier Trepat |
| El mecanoma de la adhesión epitelial: mecanismos de detección, resistencia y transmisión de fuerzas intercelulares | MINECO, I+D-Investigación fundamental no orientada | Xavier Trepat |
| MICROGRADIENTPAGE Micro Gradient Polyacrylamide Gels for High Throughput Electrophoresis Analysis | European Commission, ERC-PoC | Xavier Trepat |
| GENESFORCEMOTION Physical Forces Driving Collective Cell Migration: from Genes to Mechanism | European Commission, ERC-StG | Xavier Trepat |
| CAMVAS Coordination and migration of cells during 3D Vasculogenesis (2014-2017) | European Commission, MARIE CURIE – IOF | Xavier Trepat |
| DUROTAXIS Mecanobiología de la durotaxis: de las células aisladas a los tejidos | MINECO, Proyectos I+D Excelencia | Xavier Trepat |
Publications
Equipment
- Soft Lithography
- Micro/Nano fabrication
- Cell stretching
- Live Confocal Microcopy
- Magnetic Tweezers
- Magnetic Twisting Cytometry
- Monolayer stress microscopy
- Traction microscopy
Collaborations
- Julien Colombelli / Eduard Batlle
Institute for Research in Biomedicine (IRB) Barcelona - Marino Arroyo
Universitat Politècnica de Catalunya, Barcelona - Guillaume Charras / Roberto Mayor
University College London, UK - Erik Sahai
Cancer Research, UK - Benoit Ladoux
Université Paris 7, France - Jim Butler & Jeff Fredberg
Harvard University, Boston - Danijela Vignjevic
Institut Curie, Paris - Jonel Trebicka
Department of Internal Medicine I, University Hospital Frankfurt - Eduard Batlle
Institute for Research in Biomedicine (IRB) Barcelona
News

El Consell Europeu de Recerca beca fins a 10 projectes catalans
Diversos mitjans de comunicació s’han fet ressò de les ajudes atorgades aquest any pel Consell Europeu de Recerca a diversos projectes que s’estan duent a terme a Catalunya. Entre aquests projectes hi ha el de Xavier Trepat, cap de grup de l’IBEC.

L’investigador Xavier Trepat rep una ERC Advanced Grant per a crear les bases d’una nova generació de robots biològics
L’investigador de l’Institut de Bioenginyeria de Catalunya (IBEC), Xavier Trepat, ha rebut la prestigiosa beca ERC Advanced Grant concedida pel Consell Europeu de Recerca (ERC) i dotada amb 2.5 milions d’euros. L’expert i el seu grup destinaran aquests recursos a estudiar les propietats mecàniques de l’epiteli en 3D i a assentar les bases d’una tecnologia pionera anomenada “Epifluídica”, que permetrà dissenyar els robots biològics.

L’EMBL-IBEC Winter Conference es clausura amb un gran èxit de participació
La conferència organitzada per l’Institut de Bioingeniería de Catalunya (IBEC) i el Laboratori Europeu de Biologia Molecular (EMBL) va reunir aquesta setmana a la Pedrera de Barcelona a un total de 200 experts internacionals en el camp de la bioingeniería. En la inauguració de l’esdeveniment, que va ser a càrrec de l’alcaldessa de Barcelona Ada Colau, es va destacar la consolidació de Barcelona com a centre internacional de recerca i coneixement.

Les cèl·lules amb dos nuclis podrien ser clau en la regeneració del cor
Un equip d’investigadors de l’IBEC liderat per Xavier Trepat, en col·laboració amb el CMR[B], ha descobert un mecanisme que genera cèl·lules de dos nuclis. Aquest mecanisme s’ha identificat durant la regeneració del cor del peix zebra, i podria estar associat a l’extraordinari poder regeneratiu d’aquest animal. Després d’una lesió aguda, com un infart de miocardi, el cor humà és incapaç de regenerar-se. Les cèl·lules cardíaques adultes no poden créixer i dividir-se per substituir les danyades, i la lesió esdevé irreversible. Però això no passa en tots els animals. Un peix d’aigua dolça originari del Sud-est d’Àsia, conegut com a peix zebra, pot regenerar per complet el seu cor fins i tot després de l’amputació del 20% del seu ventricle.

L’enfocament ascendent és suficient per entendre tot un sistema?
El responsable del grup de l’IBEC, Xavier Trepat, ha publicat un article d’opinió a la secció News and Views (Notícies i Opinió) del darrer número de la revista Nature, dedicat a la «Biologia ascendent». En el seu article «Bottom does not explain top» («El nivell inferior no explica el nivell superior»), Xavier argumenta que entendre com es construeixen les estructures biològiques complexes —o fins i tot les cèl·lules com un tot—, només aporta una certa idea de com funcionen els sistemes biològics en nivells superiors d’organització. Hi ha moltes variables, com ara la densitat, o fins i tot les patologies que pot patir un subjecte, que afecten el comportament cel·lular a nivell de mesoescala, és a dir, a més llarg termini, a una escala més sistèmica que la dels components individuals d’un organisme.

Investigadors descobreixen cèl·lules superdeformables
Una de les habilitats més envejables dels superherois és la seva capacitat per estirar els seus cossos més enllà dels límits imaginables. En un estudi publicat avui a la revista Nature, científics han descobert el mecanisme que explica com les nostres cèl·lules poden fer precisament això: deformar-se de forma extrema sense trencar-se. La investigació de l’IBEC, impulsada per la Fundació Bancària “la Caixa”, i la UPC presenten una nova propietat física de les cèl·lules, que denominen superelasticitat activa, que explica la seva capacitat inusual per suportar deformacions extremes.

La teva cara prové de la part posterior del teu cap
Les cèl·lules mare embrionàries que donen forma a la cara (cèl·lules de la cresta neural) utilitzen un mecanisme inesperat per desenvolupar les característiques facials, segons revela un nou estudi dirigit per la UCL que involucra a investigadors de l’IBEC. Els investigadors han desxifrat com es mouen aquestes cèl·lules, podent ajudar a comprendre com ocorren els defectes facials, com el paladar fes i la paràlisi facial. El mecanisme recentment descrit podria ser rellevant per al desenvolupament de noves teràpies, atès que podria estar darrere d’altres processos de migració cel·lular, com la invasió del càncer durant la metàstasi o la cicatrització de ferides.
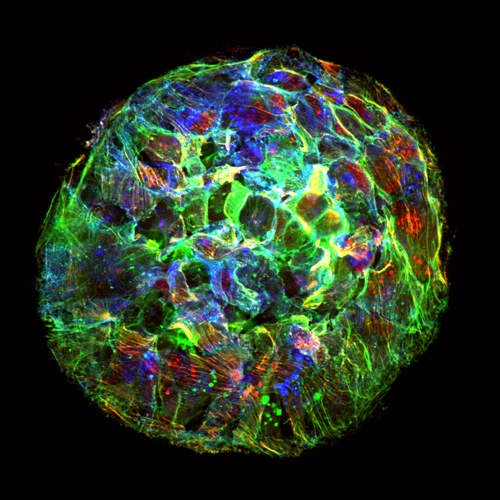
L’expansió de cèl·lules tumorals desafia la física actual
• Investigadors de l’IBEC i la UB descobreixen que l’expansió de cèl·lules tumorals no obeeix les lleis de la física tal com estan formulades actualment. Aquesta descoberta ha estat impulsada per la Fundació Bancària “la Caixa”. • En un article publicat avui a la revista Nature Physics, els investigadors reformulen aquestes lleis i desenvolupen un nou marc que pot contribuir a predir les condicions en què els tumors inicien la metàstasi. Un tumor maligne es caracteritza per la seva capacitat de disseminar-se pel seu entorn. Per fer-ho, les cèl·lules del tumor han d’adherir-se al teixit que les envolta (principalment col·lagen) i exercir-hi forces per propulsar-se.

Les forces físiques regulen la divisió cel·lular
Investigadors de l’IBEC ha descobert que la divisió cel·lular que es produeix en teixits epitelials està regulada per forces mecàniques Aquest descobriment obre la porta a una major comprensió de la proliferació descontrolada de les cèl·lules canceroses en els tumors, i a la seva possible regulació per mitjà de forces físiques. El resultat de la recerca, que s’ha publicat a la revista Nature Cell Biology, ha estat duta a terme pel grup de recerca del Xavier Trepat, professor ICREA a l’IBEC i professor associat a la UB, i en ella es relaciona l’estat mecànic del teixit amb la progressió al llarg del cicle cel·lular i divisió de les seves cèl·lules.


 ibecbarcelona.eu
ibecbarcelona.eu