About
Our lab aims at understanding how genetic changes between individuals can or cannot result in disease by quantifying the impact mutations have on protein aggregation and toxicity.
We are particularly interested in amino acid sequences that can adopt different conformations and undergo a process of self-assembly which results in distinct physical states.
The aggregation of proteins into insoluble amyloid fibrils is a key process in the pathogenesis of a number of neurodegenerative conditions, such as Parkinson’s disease or Amyotrophic Lateral Sclerosis. However, examples of functional amyloid are also widespread in nature, especially across bacteria and fungi. Our work aims at systematically deciphering the sequence-dependencies of the process of aggregation in both functional and pathological contexts.
Recently, it has become clear that proteins can also self-assemble into a more dynamic and reversible state through a process of liquid de-mixing which is thought to contribute to the organization of the intracellular space. However, also for proteins undergoing liquid de-mixing, the balance between function and dysfunction is far from clear. It is also unknown if, in vivo, liquid de-mixed states are precursors of insoluble amyloid-like states, and to which extent proteins are structured once in the liquid state.
How we do it
In order to understand how mutations affect these delicate equilibria and to elucidate when and why a sequence starts aggregating or becomes toxic for the cell, our lab integrates experimental and computational approaches in different model systems. Recently, we have developed massively parallel approaches based on Deep Mutational Scanning (DMS) to quantify the toxicity or the aggregation propensity of hundreds of thousands of protein sequences in vivo. We believe that by portraying the full landscape of the effects of mutations in a specific protein domain we can reach a more systematic and comprehensive understanding of the determinants of amyloid formation and toxicity.
We are also interested in developing similar high-throughput strategies to measure in vivo the effect of mutations on the physical state the proteins acquire upon mutation (diffuse, liquid de-mixed, insoluble) and to study the interactions between mutations to report on the conformations proteins adopt as they self-assemble. Overall, the exhaustive datasets we are generating will give mechanistic insights on the process of protein aggregation, while also reporting on specific conformations and mechanisms leading to cellular toxicity. We also aim at using the datasets we generate to develop novel predictors of protein aggregation.
We focus on all classical amyloids, such as the amyloid-beta peptide, the main component of the plaques found in Alzheimer’s disease patients, but also on functional amyloids and on a less characterized part of the human proteome which is able to undergo liquid de-mixing: prion-like domains. Just like all disordered protein regions, prion-like domains are particularly difficult to study in vitro. In this perspective, in vivo approaches such as the ones we develop, can provide a unique opportunity to investigate these sequences in a systematic way.
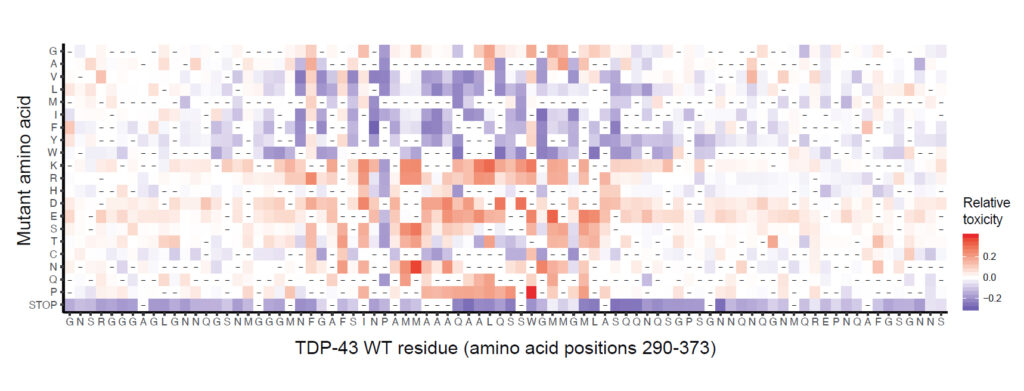
Map of the effect of mutations on toxicity of the TDP-43 Prion-like Domain.
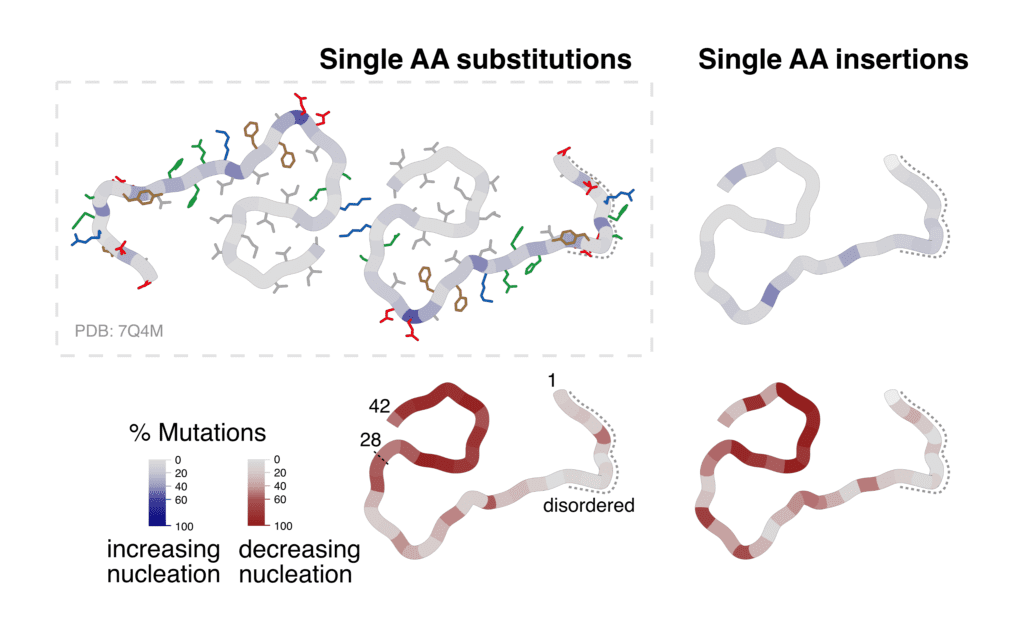
Percentage of substitutions and insertions increasing or decreasing amyloid formation of the Amyloid-Beta peptide, visualized on the cross-section of ex-vivo fibrils (7Q4M).
Staff
Projects
| NATIONAL GRANTS | FINANCER | PI |
|---|---|---|
| AMYNDEL · Deciphering the consequences of different types of genetic variation in amyloid forming sequences by deep mutagenesis ( 2022-2025) | MICIU · Generación Conocimiento: Proyectos I+D | Benedetta Bolognesi |
| DeepAmyloids · Massively parallel mutagenesis to understand, predict and prevent amyloid nucleation in neurodegenerative diseases (2021-2024) | Obra Social La Caixa | Benedetta Bolognesi |
| FINISHED PROJECTS | FINANCER | PI |
|---|---|---|
| Poly-STOP · Developing modulators of protein aggregation in polyglutamine diseases by deep mutational scanning (2021-2022) | BIST · Barcelona Institute of Science and Technology | Benedetta Bolognesi |
| PRIOMUT · Escaneado exhaustivo de mutaciones en un dominio priónico para entender la toxicidad inducida por proteínas (2019-2021) | MICIU / Retos investigación: Proyectos I+D | Benedetta Bolognesi |
Publications
Equipment
- Thermo MaxQ 8000
Collaborations
- Priyanka Narayan
NIH-NIDDK - Xavier Salvatella
IRB, Barcelona - Fran Supek
IRB, Barcelona - Ben Lehner
CRG, Barcelona - Luke McAlary /Justin Yerbury
University of Wollongong, Australia
News
BIST Forum, una trobada per posar en valor la recerca de frontera
El BIST Forum ha tractat de com la ciència d’excel·lència potencia el desenvolupament de la societat i el creixement econòmic. Hi han assistit el president de la Generalitat, l’alcalde de Barcelona, els responsables de les màximes institucions econòmiques i els rectors de les principals universitats. A l’acte s’han anunciat els nous projectes BIST IGNITE per la recerca multidisciplinària, dels quals tres compten amb la participació de l’IBEC.
La investigadora Benedetta Bolognesi guardonada amb una prestigiosa beca europea ERC Consolidator Grant
La investigadora de l’Institut de Bioenginyeria de Catalunya ha estat guardonada amb una «ERC Consolidator Grant». Aquest prestigiós finançament europeu dona suport a científics en l’etapa de consolidació dels seus equips de recerca, permetent-los perseguir idees científiques innovadores. 2 milions d’euros durant 5 anys permetran a Bolognesi i el seu equip desenvolupar un nou mètode per identificar les mutacions que condueixen a la formació d’amiloides, agregats de proteïnes que causen multitud de malalties, incloent-hi l’Alzheimer o La investigadora de l’Institut de Bioenginyeria de Catalunya ha estat guardonada amb una «ERC Consolidator Grant». Aquest prestigiós finançament europeu dona suport a científics en l’etapa de consolidació dels seus equips de recerca, permetent-los perseguir idees científiques innovadores. 2 milions d’euros durant 5 anys permetran a Bolognesi i el seu equip desenvolupar un nou mètode per identificar les mutacions que condueixen a la formació d’amiloides, agregats de proteïnes que causen multitud de malalties, incloent-hi l’Alzheimer o el Parkinson.
Un nou atles revela quines mutacions estan darrere de la formació nociva d’amiloide
Investigadors de l’Institut de Bioenginyeria de Catalunya (IBEC) han elaborat l’atles més complet fins avui amb les mutacions genètiques que causen la formació de fibril·les d’amiloide BETA, una proteïna que està darrere de la … Read more
Ciència i Art: l’IBEC col·labora en una obra d’Antoni Muntadas a l’Ars Electronica 2022
Quan es considera extint un ésser viu? Aquesta és una de les qüestions fonamentals de l’obra d’art presentada a l’Ars Electronica 2022 per Antoni Muntadas, artista català establert als EUA … Read more
Postdoctoral researcher at the Protein Phase Transitions in Health and Disease Research group
Ref: Postdoctoral / Deadline: 24th August
Lab Technician at the Protein phase transitions in health and disease Research Group
Ref: Lab Technician / Deadline: 29th July 2022
Investigadors de l’IBEC i CRG reben finançament de la Fundació “la Caixa” per a lluitar contra la demència
La Fundació “la Caixa” finançarà un ampli i innovador projecte de recerca codirigit per Benedetta Bolognesi, Júnior Group Leader a l’IBEC, i pel professor de recerca ICREA Ben Lehner del CRG, l’objectiu del qual és conèixer millor les causes genètiques que condueixen a malalties neurodegeneratives. Els investigadors combinaran tècniques de “mutagenesis profunda” i aprenentatge automàtic per a produir un “mapa de la demència” com a mètode per a predir si una persona és més susceptible a patir aquestes malalties.
IBEC researchers win two “BIST Ignite Seed Grants”
IBEC researchers receive two “Ignite Seed Grants” to combine their skills with other BIST members to seek scientific answers to health challenges. Benedetta Bolognesi will study, with the IRB, Huntington’s disease and other neurodegenerative pathologies without treatment. On the other hand, Juan Manuel Fernández-Costa and researchers at ICFO will develop muscles-on-a-chip and biomagnetism sensors to accelerate the design of new treatments for muscular dystrophy.
Un pas més cap a la detecció precoç de l’Alzheimer
Benedetta Bolognesi, líder de grup de l’IBEC, apareix en diferents mitjans per un recent estudi publicat a la revista eLife. A l’estudi mostren el primer mapa amb milers de mutacions en el gen que codifica el pèptid beta amiloide para predir quines persones són més propenses a desenvolupar la malaltia de l’Alzheimer.
El primer mapa complet de mutacions de plaques amiloides obre noves vies per a la detecció precoç de la malaltia d’Alzheimer
Un estudi publicat a la revista eLife analitza totes les mutacions possibles en el pèptid beta amiloide i determina com influeixen en la seva agregació en plaques, un distintiu patològic de la malaltia d’Alzheimer. També ajudarà els investigadors a entendre millor els mecanismes biològics que controlen l’aparició de la malaltia.
Jobs
Research Assistant at the Protein Phase Transitions in Health and Disease Research Group (RA_BB)
Ref: RA_BB // Deadline: 26/01/2024
Senior Laboratory Technician at the Protein Phase Transitions in Health and Disease Research Group (SLT_BB)
Ref: SLT_BB // Deadline: 11/01/2024
Research Assistant at the Protein Phase Transitions in Health and Disease Research Group
Ref: RA_BB // Deadline: 04/08/2023
Research Assistant at the Protein Phase Transitions in Health and Disease Research Group
Ref : RA_BB // Deadline 28/04/2023
Postdoctoral researcher at the Protein Phase Transitions in Health and Disease Research group
Ref: Postdoctoral / Deadline: 24th August
Lab Technician at the Protein phase transitions in health and disease Research Group
Ref: Lab Technician / Deadline: 29th July 2022
2 Postdoctoral researchers at the Protein Phase Transitions in Health and Disease Research Group
Application Deadline: 24/10/2021Ref: PD-BB The Protein phase Transitions in Health and Disease group at the Institute for Bioengineering of Catalonia (IBEC) is looking for two Postdoctoral Researchers to develop deep mutagenesis projects in the context of amyloid forming proteins. The contract will be within the framework of a larger project funded by La Caixa.


 ibecbarcelona.eu
ibecbarcelona.eu