Un estudi dirigit per l’Institut de Bioenginyeria de Catalunya (IBEC) i l’Institut de Biologia Molecular de Barcelona (IBMB) ofereix la imatge més detallada fins a la data de l’NrdR, el regulador principal dels ribonucleòtids (RNR) en els bacteris. Els investigadors van obtenir les primeres imatges detallades de l’estructura completa de la proteïna l’NrdR i van demostrar com els canvis en la forma i l’associació d’aquesta proteïna afecten la manera en què controla processos clau dins de la cèl·lula. Les troballes, publicades recentment a la revista International Journal of Biological Macromolecules, amplien la nostra comprensió de com els bacteris regulen la producció dels components moleculars de l’ADN, un aspecte crucial tant per a la microbiologia fonamental com per al desenvolupament de noves estratègies antimicrobianes.

Els ribonucleòtids (RNR) són enzims indispensables que converteixen els ribonucleòtids en desoxirribonucleòtids (dNTP), els precursors que componen l’ADN. Atès que la síntesi de l’ADN és fonamental per a la supervivència cel·lular, l’activitat de les RNR s’ha de controlar de manera molt estricta. En els bacteris, aquest control l’exerceix un regulador transcripcional especialitzat, l’NrdR, que no té equivalent en els organismes eucariotes i, per tant, representa una diana potencial per al desenvolupament d’antimicrobians. Malgrat el seu paper central, la base estructural de la funció de l’NrdR i els mecanismes pels quals detecta els nivells de nucleòtids cel·lulars i modula l’expressió dels RNR només es coneixien parcialment fins al moment.
Ara, aquest estudi aborda aquesta llacuna combinant la biologia estructural, la caracterització biofísica i els assajos funcionals per dibuixar com l’estructura quaternària de l’NrdR respon a diferents estats de nucleòtids i com aquests canvis afecten la seva activitat reguladora. Els investigadors van centrar el seu estudi en dos importants patògens bacterians: Escherichia coli, un patogen model clau per a l’estudi de la fisiologia bacteriana fonamental, i Pseudomonas aeruginosa, un patogen oportunista reconegut per la seva resistència inherent a molts antibiòtics i el seu paper en les infeccions cròniques. El treball de recerca va ser dirigit pel grup Infeccions Bacterianes: Teràpies Antimicrobianes, de l’Institut de Bioenginyeria de Catalunya (IBEC) i el grup de Biologia Estructural de Macromolècules Mitocondrials de l’Institut de Biologia Molecular de Barcelona (IBMB-CSIC), amb la participació del grup de Caracterització Bioelèctrica a la Nanoescala de l’IBEC.
L’NrdR com a possible nova diana contra les infeccions bacterianes
Apuntar a un regulador tan important podria debilitar els bacteris patògens o ajudar a restaurar la seva susceptibilitat als antibiòtics existents, cosa que representa una via prometedora per contrarestar la creixent resistència als antimicrobians.
Eduard Torrents
La caracterització exhaustiva de l’estructura i el mecanisme de NrdR suposa un avenç significatiu en la nostra comprensió de la regulació transcripcional bacteriana. En revelar com els bacteris regulen la síntesi de desoxiribonucleòtids en resposta a les fluctuacions de nucleòtids, aquest treball proporciona una base conceptual i experimental per a la identificació de nous objectius antibacterians i la innovació terapèutica futura.
Entendre com l’NrdR detecta els nivells de nucleòtids i controla l’expressió de gens RNR essencials proporciona un nou punt de partida estratègic per al desenvolupament d’antimicrobians. Atès que NrdR està absent en les cèl·lules humanes i exerceix un paper fonamental en la síntesi de precursors de l’ADN bacterià, els coneixements estructurals descoberts aquí ofereixen una base sòlida per dissenyar molècules que alterin selectivament l’homeòstasi dels nucleòtids bacterians. Aquests coneixements posicionen NrdR com una diana antimicrobiana molt interessant la manipulació de la qual pot inspirar estratègies de pròxima generació per combatre les infeccions bacterianes resistents.
«Apuntar a un regulador tan important podria debilitar els bacteris patògens o ajudar a restaurar la seva susceptibilitat als antibiòtics existents, cosa que representa una via prometedora per contrarestar la creixent resistència als antimicrobians», explica Eduard Torrents, investigador principal del grup Infeccions Bacterianes: teràpies antimicrobianes de l’IBEC, professor associat de la Universitat de Barcelona (UB), membre d’ICREA Acadèmia i autor de l’estudi.
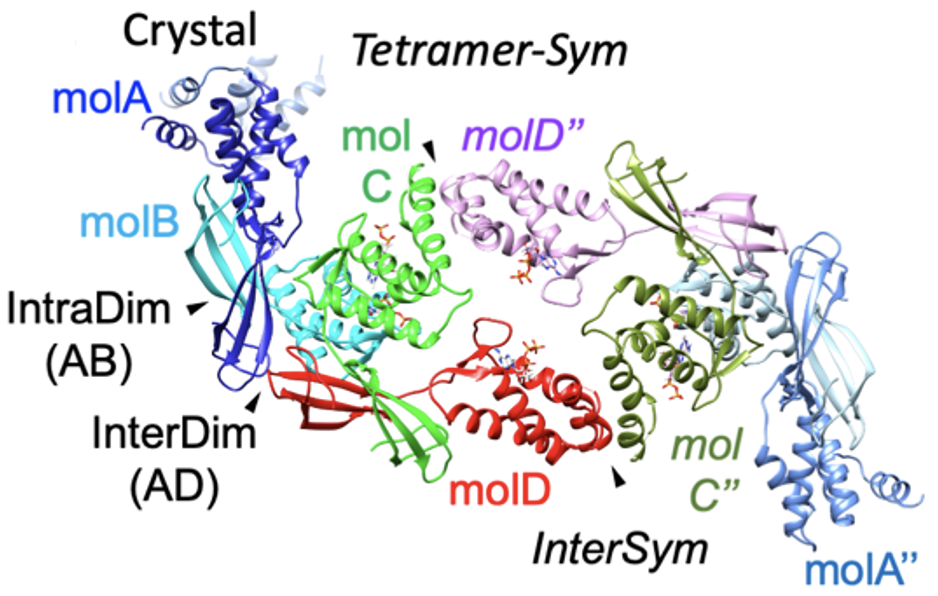
Desxifrant l’estructura 3D de l’NrdR i la seva importància biològica
Els investigadors van identificar primer quins gens estan controlats per l’NrdR en aquests bacteris integrant dades transcriptòmiques amb anàlisi de motius, cosa que va proporcionar una imatge més clara de com aquest regulador influeix en els processos cel·lulars essencials. A continuació, l’equip va determinar, mitjançant cristal·lografia de proteïnes amb raigs X, l’estructura tridimensional de la proteïna l’NrdR a E. coli, descobrint com les molècules de proteïna s’associen entre si per formar assemblatges. Tot i que van utilitzar diferents tècniques, com la dispersió de llum multiangle (SEC-MALS) i la microscòpia de força atòmica, els investigadors també van examinar com aquests assemblatges canvien en resposta a la presència de diferents nucleòtids, revelant un sistema altament dinàmic regulat per aquests metabòlits. «Després de determinar l’estructura cristal·lina, el següent pas crucial és desxifrar si les interaccions observades en el vidre tenen significat biològic, en aquest cas, com l’NrdR respon als nucleòtids», afirma Maria Solà, investigadora principal del grup de Biologia Estructural de Macromolècules Mitocondrials de l’Institut de Biologia Molecular de Barcelona (IBMB-CSIC) i autora de l’estudi.
Després de determinar l’estructura cristal·lina, el següent pas crucial és desxifrar si les interaccions observades en el vidre tenen significat biològic, en aquest cas, com l’NrdR respon als nucleòtids.
Maria Solà
Per abordar l’impacte dels estats estructurals en l’activitat d’unió a l’ADN i la regulació, els investigadors van realitzar una validació funcional de les interaccions proteïna-proteïna observades en el cristall utilitzant mutacions puntuals, assajos de desplaçament de mobilitat electroforètica i assajos de transcripció in vitro. És important destacar que el treball aclareix com l’NrdR respon als senyals intracel·lulars —en particular, ATP i dATP— per canviar entre estats actius i repressius, ajustant així l’expressió de RNR d’acord amb les necessitats cel·lulars, explica Lucas Pedraz, co-primer autor de l’estudi. Aquestes troballes s’oposen a les visions anteriors, més simplistes, de la regulació de l’NrdR, i revelen un mecanisme finament ajustat pel qual la unió de nucleòtids impulsa transicions estructurals que influeixen directament en la unió a l’ADN i la repressió gènica.
En conjunt, aquests resultats posicionen l’NrdR com una nova diana prometedora en la lluita contra la resistència als antimicrobians, ja que ofereix una oportunitat única per interrompre una via reguladora essencial per a la supervivència dels bacteris, absent en els éssers humans. En definir l’estructura de l’NrdR i revelar com governa l’homeòstasi dels nucleòtids, aquest treball no només aprofundeix la nostra comprensió de la biologia bacteriana, sinó que també estableixi una base sòlida per al desenvolupament de teràpies de pròxima generació. A mesura que la resistència als antibiòtics continua augmentant a tot el món, aquests coneixements proporcionen un trampolí crucial per a estratègies innovadores que debilitin els bacteris patògens i restaurin l’eficàcia dels tractaments existents.
Article de referència
Lucas Pedraz, Arkadiusz Szura, Claus Schmitz, Alba Rubio-Canalejas, Ángela Martínez-Mateos, Anthony Santella, Gabriel Gomila, Annalisa Calo, Maria Solà, Eduard Torrents. Structure and mechanistic basis of NrdR, a bacterial master regulator of ribonucleotide reduction. International Journal of Biological Macromolecules (2024). DOI: https://doi.org/10.1016/j.ijbiomac.2026.150647





