Investigadors de l’Institut de Bioenginyeria de Catalunya (IBEC) han elaborat l’atles més complet fins avui amb les mutacions genètiques que causen la formació de fibril·les d’amiloide BETA, una proteïna que està darrere de la malaltia d’Alzheimer. L’estudi, liderat per la investigadora de l’IBEC, Benedetta Bolognesi, en col·laboració amb el grup de Bel Lehner en el Centre de Regulació Genòmica (CRG), ha estat publicat en la prestigiosa revista científica Nature Communications.
Les fibril·les amiloide són agregats de proteïnes que s’acumulen al voltant de les cèl·lules, sense que l’organisme aconsegueixi descompondre-les. La seva presència i procés de formació semblen ser la causa de més de 50 malalties humanes, incloses la malaltia d’Alzheimer, la malaltia de Parkinson, la demència frontotemporal, l’esclerosi lateral amiotròfica (ELA) i la diabetis tipus II.
Els investigadors ja han aconseguit descobrir l’estructura de moltes fibril·les d’amiloide. No obstant això, el mecanisme pel qual es formen, conegut com a reacció de nucleació, continua sent un misteri. Entendre aquest mecanisme és fonamental si es volen prevenir algunes de les principals patologies que afecten la nostra societat.
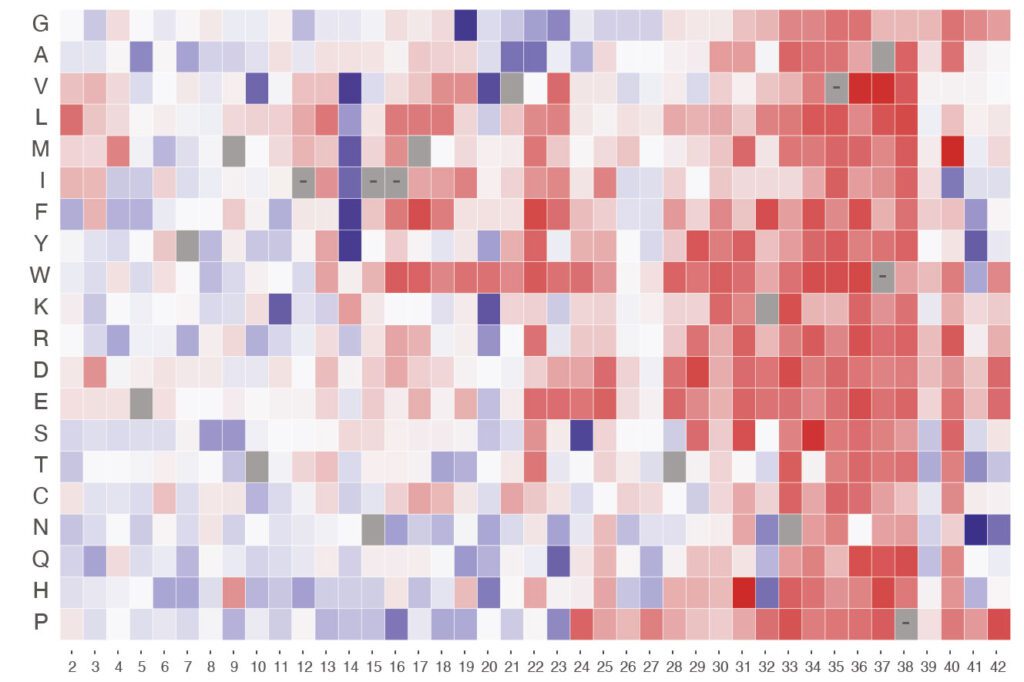
Amb l’escaneig mutacional profund, una tècnica d’anàlisi cel·lular d’alt rendiment, s’aconsegueixen caracteritzar milers de mutacions genètiques que condueixen a l’agregació de la proteïna amiloide. Fins ara les tècniques d’exploració de mutacions profundes tendeixen a observar només substitucions (mutacions en les quals un bloc de construcció d’ADN reemplaça a un altre), i ignorar, en gran manera, altres tipus com les insercions (mutacions on s’afegeix un bloc de construcció) o les delecions (mutacions en les quals s’elimina un bloc de construcció) a pesar de que tots dos mecanismes poden ser determinants per a l’acumulació d’amiloide.
Mireia Seuma, investigadora del grup de Benedetta Bolognesi en l’IBEC, ha aconseguit desenvolupar un atles complet que compara els múltiples tipus de mutacions i avalua el seu paper en la formació de fibril·les d’amiloide. El seu treball es va publicar recentment en la prestigiosa revista científica Nature Communications.
Mutacions que emmalalteixen
L’estudi en qüestió va analitzar un pèptid de 42 aminoàcids, on es van identificar 307 mutacions que acceleren l’acumulació d’amiloide, un 10% del total de les mutacions detectades, entre les quals es trobaven moltes que no corresponien a substitucions, sinó a alteracions del tipus inserció i deleció. D’altra banda, l’elevat nombre de mutacions identificades en aquest pèptid tan curt posa de manifest l’enorme diversitat de variacions que es poden donar en el genoma humà. Aquestes mutacions poden resultar o no en malaltia, ressaltant la necessitat de saber quin impacte tenen en la nucleació d’amiloide.
A més, els investigadors van observar que el 87% de les mutacions amb probabilitat de ser patogèniques es troben en un extrem específic del pèptid, conegut com a N-terminal. Els truncaments en aquesta regió van resultar ser especialment eficaces accelerant la nucleació i es preveu, per tant, que aquesta regió jugui un gran paper en el desenvolupament de l’Alzheimer.
En el seu conjunt, aquest treball proporciona una guia integral per a la interpretació clínica futura de les mutacions i resulta en una eina molt útil per a aquells investigadors que realitzen recerques bàsiques i clíniques sobre tots els trastorns que s’amaguen darrere dels agregats d’amiloide.
Reference article: Seuma, M., Lehner, B. & Bolognesi, B. An atlas of amyloid aggregation: the impact of substitutions, insertions, deletions and truncations on amyloid beta fibril nucleation. Nat Commun 13, 7084 (2022). https://doi.org/10.1038/s41467-022-34742-3





