
Comprendre les característiques biològiques dels biofilms, causa de la majoria de les infeccions bacterianes, és el primer pas per a lluitar contra aquesta pandèmia silenciosa i trobar tractaments efectius.
Les infeccions bacterianes són un problema de salut pública que afecta milions de persones a tot el món i al voltant del 80% estan associades als biofilms, comunitats formades per diferents espècies de microorganismes que co-colonitzen teixits humans i dispositius mèdics. A causa de diverses característiques biològiques, els biofilms són molt més recalcitrants que les infeccions bacterianes simples i necessiten períodes més prolongats i dosis més altes d’antibiòtics per a ser tractats. Aquesta situació contribueix a incrementar la resistència global als antibiòtics que estem observant avui dia en l’àmbit hospitalari.
En aquest context, Pseudomonas aeruginosa és un bacteri que pot coexistir i interactuar amb una àmplia gamma de microorganismes en biofilms provocant nombroses infeccions d’alt impacte clínic i que sovint condueixen a infeccions cròniques. Ara, Eduard Torrent, líder del grup “Infeccions bacterianes: teràpies antimicrobianes” de l’IBEC i professor del Departament de Genètica, Microbiologia i Estadística de la Facultat de Biologia de la Universitat de Barcelona (UB), i Maria de la Mar Cendra, investigadora post doctoral en el seu laboratori, publiquen en la revista Biotechnology Advances, una revisió completa que descriu aspectes clau dels biofilms de P. aeruginosa, incloent-hi les principals espècies de microorganismes que poden coexistir i l’impacte negatiu que poden tenir en la clínica.
Biofilms de P. aeruginosa
La gran capacitat de P. aeruginosa per a créixer en biofilms amb fongs, virus i altres bacteris (gairebé mai es troba infectant sola) i per a colonitzar dispositius mèdics i teixits humans és un creixent problema de salut pública mundial. Aquests biofilms tenen una major tolerància als antibiòtics i major resistència a les respostes de defensa de l’hoste. En aquesta revisió, els investigadors desxifren la implicació de P. aeruginosa en els biofilms i obren les portes a trobar solucions en un futur pròxim.
Només amb el desenvolupament continu i estratègies eficients enfront dels biofilms podem abordar la recurrència i la cronicitat causades per les infeccions de biofilms de P. aeruginosa.
Eduard Torrents, líder del grup “Infeccions bacterianes: teràpies antimicrobianes” de l’IBEC i professor de la UB.
P. aeruginosa interactua amb molts virus respiratoris en infeccions cròniques, inclòs el SARS-CoV-2, l’agent causal de la pandèmia de COVID-19. Estudis d’altres investigadors han demostrat que el 7% dels pacients hospitalitzats infectats amb SARS-CoV-2 patien coinfecció bacteriana, P. aeruginosa sent present en el 12% dels casos. A més, P. aeruginosa pot colonitzar dispositius mèdics com els tubs endotraqueals, utilitzats en pacients amb COVID-19 que necessiten respiració assistida. S’ha trobat formació de biofilm en el 95% dels pacients intubats durant més de 24 h. Aquest tipus de biofilms, en els quals P. aeruginosa és el principal agent causal, són perdurables i poden resistir malgrat el tractament amb antibiòtics, la qual cosa augmenta el risc d’infeccions respiratòries.
P. aeruginosa, juntament amb els bacteris Staphylococcus aureus i Streptococcus, també juga un paper protagonista en les infeccions per biofilms associades a la fibrosi quística (40-60% del total), un trastorn genètic que afecta principalment els pulmons, però també al pàncrees, fetge, ronyons i intestí. A més, també és un patogen rellevant en infeccions cròniques de ferides i lesions cutànies, i en queratitis, una infecció corneal comú relacionada amb la formació de biofilms bacterians sobre lentilles de contacte.
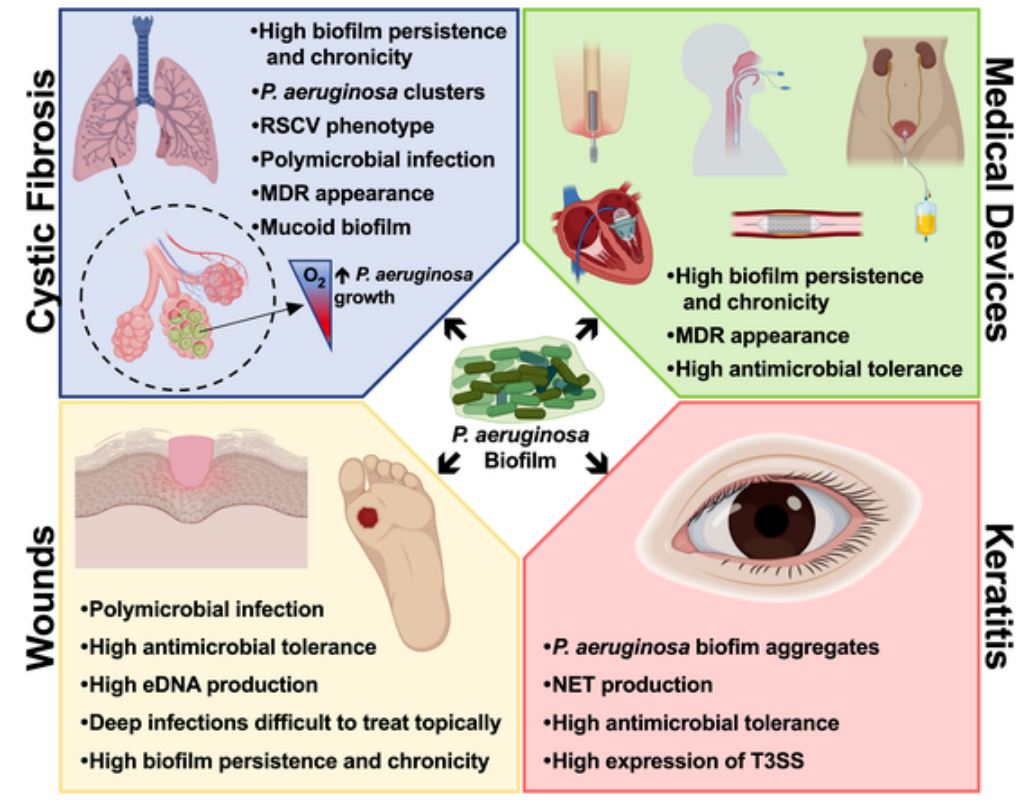
Fig 1. Principals característiques dels biofilms de P. aeruginosa i les seves conseqüències en la progressió d’infeccions.
Todos per a un i un per a tots
Els biofilms bacterians estan formats per diferents espècies que colonitzen i creixen juntes en els teixits humans, provocant infeccions en el tracte urinari, pulmó i ronyó entre altres, i en superfícies de dispositius mèdics, com a pròtesis articulars, vàlvules cardíaques i marcapassos, implants dentals i mamaris, sutures i catèters. Aquesta àmplia presència dona una idea de l’impacte de gran abast dels biofilms en l’àmbit clínic.
L’estil de vida gregari en el qual els bacteris es protegeixen entre si fa que sigui extremadament difícil lluitar contra els biofilms amb els enfocaments clàssics utilitzats contra les infeccions bacterianes individuals. Els bacteris produeixen substàncies extracel·lulars que actuen com a suport i protecció per a tota la comunitat. També tenen la capacitat de comunicar-se entre elles mitjançant un complex sistema químic conegut com a “quòrum sensing” per a regular de manera coordinada el creixement i l’establiment del biofilm.
En conjunt, les característiques dels biofilms els fan més resistents als antibiòtics, a les tensions externes i a les respostes de defensa del pacient. En alguns casos, per a tractar eficaçment una infecció per biofilm bacterià, la dosi d’antibiòtic utilitzada s’ha de multiplicar per 1000 en comparació amb una infecció simple, una concentració difícil d’aconseguir en pacients sense causar toxicitat. La majoria de vegades, les infeccions per biofilms només poden tractar-se mitjançant la seva eliminació, la qual cosa ho fa sovint inassequible i condueix a un desgast mental en els pacients. A més, les infeccions causades simultàniament per diferents espècies sovint s’associen amb un pitjor pronòstic.
Mesures actuals i futures per a lluitar contra els biofilms bacterians
La complexitat per a tractar les infeccions per biofilms bacterians amb antibiòtics i l’aparició de resistències va portar a l’aplicació de nous enfocaments antimicrobians amb l’objectiu d’inhibir l’adhesió dels bacteris a les superfícies, desagregar i dispersar-les. Aquests inhibeixen la producció d’uns certs components que promouen la formació de biofilms i augmenten la difusió d’antibiòtics al seu interior. Per exemple, l’ús d’inhibidors de detecció de “quòrum sensing”, compostos que degraden el biofilm i pèptids antimicrobians dirigits a molècules específiques de P. aeruginosa són les estratègies més utilitzades. Els sistemes d’administració de fàrmacs obtinguts per bioenginyeria són una bona alternativa per a alliberar agents terapèutics dins del biofilm, augmentant l’especificitat i reduint la toxicitat per al pacient.
Històricament, les infeccions bacterianes s’han estudiat in vitro utilitzant espècies individuals, sense tenir en compte els biofilms. No obstant això, ara sabem que els biofilms són la principal forma de creixement bacterià en la naturalesa i la causa de la majoria de les infeccions bacterianes humanes. “El veritable desafiament ara és recrear models en el laboratori capaços de reproduir les característiques biològiques i fisiològiques dels biofilms bacterians”, conclou Maria de la Mar Cendra, primera autora del treball.
Article de referència: Maria del Mar Cendra and Eduard Torrents. Pseudomonas aeruginosa biofilms and their partners in crime. Biotechnology Advances (2021), 49, article 107734.





