
Aquest primer mapa complet de mutacions té el potencial d’ajudar els genetistes clínics a predir si les mutacions que es troben en la beta amiloide poden fer que un individu sigui més propens al desenvolupament de la malaltia d’Alzheimer. A més, també ajudarà els investigadors a entendre millor els mecanismes biològics que controlen l’aparició de la malaltia.
“La seqüenciació genètica dels individus és cada cop més comú. Com a resultat, estem trobant cada vegada més mutacions, però manquem els criteris per a predir el seu resultat. Són malignes i requereixen intervenció? O són neutrals o benignes?”, declara Benedetta Bolognesi, una de les principals autores de l’estudi i líder junior de grup a l’Institut de Bioenginyeria de Catalunya, IBEC. “Els especialistes poden utilitzar aquest mapa de manera proactiva per interpretar l’efecte d’una mutació, de manera que quan es troba en un individu, ja sabem que significa i amb sort, que hem de fer. S’han construït mapes similars per al gen BRCA1 i el càncer de mama en el passat, i és emocionant que puguem replicar això per la malaltia d’Alzheimer.”
Segons Ben Lehner, professor de recerca ICREA en el Centre de Regulació Genòmica (CRG) i coautor de l’estudi, “aquesta és la primera anàlisi a gran escala i el primer mapa complet de com les mutacions promouen i prevenen que una proteïna formi fibril·les amiloides, donant-nos una visió sense precedents d’aquest mecanisme, que també representa la principal diana terapèutica en la malaltia d’Alzheimer”. 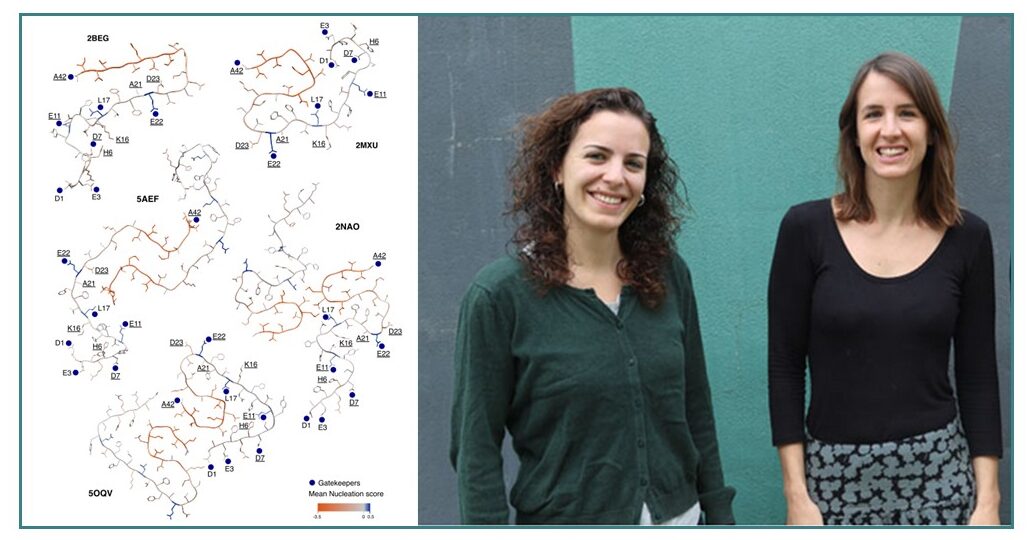
Imatge: a l’esquerra, els efectes mitjana de les mutacions en beta amiloide visualitzats en talls transversals de variants de fibril·les amiloide. Taronja: les mutacions en aquesta posició disminueixen, en mitjana, l’agregació amiloide. Blau: les mutacions en aquesta posició augmenten, en mitjana, l’agregació amiloide. Al centre i a la dreta, les primeres i últimes autores de l’obra respectivament, Mireia Seuma i Benedetta Bolognesi, totes dues de l’IBEC.
Les mutacions són el factor clau en l’aparició de la malaltia
La malaltia d’Alzheimer és la forma més comuna de demència, una malaltia neurodegenerativa que afecta més de 50 milions de persones a tot el món. S’han realitzat molts assajos clínics, però no existeix una prevenció o cura coneguda per a la malaltia. Els processos biològics que causen la malaltia d’Alzheimer estan associats amb el dipòsit d’agregats de proteïnes, també coneguts com a plaques o fibril·les amiloides, en el cervell. Aquestes plaques es componen principalment del pèptid beta amiloide (Aß) i la seva generació és tòxica per a les neurones. En condicions normals, els pèptids beta amiloides són solubles, però en el context de la malaltia s’adhereixen entre si, agregant-se i formant grumolls de fibril·les llargues i insolubles, en un procés que una vegada iniciat s’autoperpetua.
Estudis anteriors han demostrat que algunes formes rares hereditàries i particularment agressives de la malaltia d’Alzheimer són causades per mutacions en el gen que codifica el pèptid beta amiloide. Ara, els investigadors de l’IBEC i CRG presenten el primer mapa complet de com les mutacions afecten la formació de plaques de pèptids beta amiloides i influeixen en l’aparició de la malaltia d’Alzheimer.
Els investigadors van quantificar totes les possibles mutacions en el pèptid beta amiloide i com influeixen en la formació d’agregats mitjançant l’ús d’un sistema d’alt rendiment basat en cèl·lules, el creixement de les quals depèn de l’agregació de les diferents versions de Aß en el seu interior. Això els va permetre provar els efectes de més de 14.000 versions diferents de Aß en un sol experiment.
Com a resultat, van observar que el Aß42, la forma més abundant de pèptid Aß, té una organització modular; la taxa d’agregació pot augmentar amb mutacions al començament del pèptid, mentre que disminueix quan ocorren mutacions a la regió final i hidròfoba del pèptid. Els investigadors també van trobar que la càrrega elèctrica del pèptid juga un paper important en la prevenció de l’agregació.
Una tècnica robusta que es pot aplicar a altres malalties
Els investigadors també van analitzar les catorze mutacions conegudes en el pèptid Aß que causen la malaltia d’Alzheimer familiar, una forma hereditària de la malaltia. Van trobar que les catorze mutacions augmenten l’agregació del pèptid Aß. Segons els autors, aquesta és una troballa molt important que suggereix que el mecanisme bioquímic observat en aquest treball és molt similar, i possiblement el mateix, al que causa la malaltia humana.
“Aquestes mutacions són extremadament rares i es relacionen amb un nombre relativament petit de casos de malaltia d’Alzheimer. No obstant això, algunes ocorreran sens dubte en algun individu actualment viu en el planeta i, per tant, hem de poder predir les que són nocives i que causaran la malaltia. Això pot ajudar-nos a identificar de manera precoç, si una persona té probabilitats de desenvolupar la malaltia per a així prendre mesures preventives quan sigui possible”, conclou Benedetta Bolognesi.
Aquestes catorze mutacions conegudes són menys del 4% de totes les mutacions que poden ocórrer en Aß. Aquest nou treball mesura els efectes de totes les més de 350 mutacions addicionals en Aß, identificant aquelles que acceleren la formació d’agregats i, per tant, les mutacions que tenen més probabilitats de causar la malaltia d’Alzheimer.
Ara estem desitjant construir mapes per a altres proteïnes que causen diferents malalties neurodegeneratives com la malaltia de Parkinson i veure que les dades del nostre atles s’utilitzen en la clínica.
Mireia Seuma, primera autora del treball i investigadora de l’IBEC.
Aquest projecte és un estudi pilot per a una important col·laboració internacional anomenada “Atles of Variant Effects” (https://www.varianteffect.org/) que té com a objectiu caracteritzar els efectes de cada possible mutació en el genoma humà i identificar i comprendre totes les mutacions que provoquen milers de malalties diferents.
Article de referència: Mireia Seuma, Andre J. Faure, Marta Badia, Ben Lehner, Benedetta Bolognesi. “The genetic landscape for amyloid beta fibril nucleation accurately discriminates familial Alzheimer’s disease mutations.” eLife 2021; 10:e63364.





