
Este primer mapa completo de mutaciones tiene el potencial de ayudar a los genetistas clínicos a predecir si las mutaciones encontradas en el péptido beta amiloide pueden hacer que un individuo sea más propenso a desarrollar la enfermedad de Alzheimer en el futuro. También ayudará a los investigadores a comprender mejor los mecanismos biológicos que controlan la aparición de la enfermedad.
“La secuenciación genética de los individuos es cada vez más común. Como resultado, encontramos cada vez más mutaciones, pero carecemos de los criterios para predecir su resultado. ¿Son malignos y requieren intervención? ¿O son neutrales o benignos? » declara Benedetta Bolognesi, una de las autoras principales del estudio y junior líder de grupo en el Instituto de Bioingeniería de Cataluña, IBEC. “Los especialistas pueden utilizar este mapa de forma proactiva para interpretar el efecto de una mutación de modo que cuando se encuentre en un individuo ya sepamos lo que significa y, con suerte, qué hacer. Se han construido mapas similares para el gen BRCA1 y el cáncer de mama en el pasado y es emocionante que podamos replicar esto para la enfermedad de Alzheimer «.
Según Ben Lehner, profesor de investigación ICREA en el Centro de Regulación Genómica (CRG) y coautor del estudio, “este es el primer análisis a gran escala y el primer mapa completo de cómo las mutaciones promueven y previenen que una proteína forme fibrillas amiloides, lo que nos da una visión sin precedentes de este mecanismo, que también representa la principal diana terapéutica en la enfermedad de Alzheimer”.
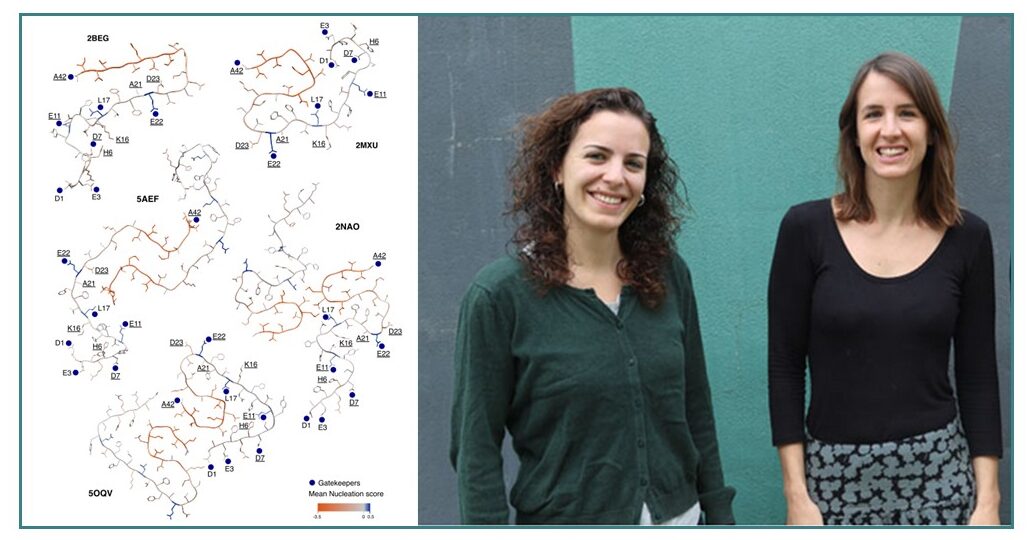
Imagen: a la izquierda, los efectos promedio de las mutaciones en beta amiloide visualizados en cortes transversales de variantes de fibrillas amiloide. Naranja: las mutaciones en esta posición disminuyen, en media, la agregación amiloide. Azul: las mutaciones en esta posición aumentan, en media, la agregación amiloide. Al centro y a la derecha, las primeras y últimas autoras de la obra respectivamente, Mireia Seuma y Benedetta Bolognesi, ambas del IBEC.
Las mutaciones son el factor clave en la aparición de la enfermedad
La enfermedad de Alzheimer es la forma más común de demencia, una enfermedad neurodegenerativa que afecta a más de 50 millones de personas en todo el mundo. Se han realizado muchos ensayos clínicos, pero no existe una prevención o cura conocida para la enfermedad. Los procesos biológicos que causan a la enfermedad de Alzheimer están asociados con el depósito de agregados de proteínas, también conocidas como placas o fibrillas amiloides, en el cerebro. Estas placas se componen principalmente del péptido beta amiloide (Aß) y su generación es tóxica para las neuronas. En condiciones normales, los péptidos beta amiloides son solubles, pero en el contexto de la enfermedad se adhieren entre sí, agregándose y formando grumos de fibrillas largas e insolubles, en un proceso que una vez iniciado se autoperpetúa.
Estudios anteriores han demostrado que algunas formas raras hereditarias y particularmente agresivas de la enfermedad de Alzheimer son causadas por mutaciones en el gen que codifica el péptido beta amiloide. Ahora, los investigadores del IBEC y CRG presentan el primer mapa completo de cómo las mutaciones afectan la formación de placas de péptidos beta amiloides e influyen en la aparición de la enfermedad de Alzheimer.
Los investigadores cuantificaron todas las posibles mutaciones en el péptido beta amiloide y cómo influyen, en la formación de agregados mediante el uso de un sistema de alto rendimiento basado en células, en el que su crecimiento depende de la agregación de las diferentes versiones de Aß en su interior. Esto les permitió probar los efectos de más de 14.000 versiones diferentes de Aß en un solo experimento.
Esto reveló que el Aß42, la forma más abundante de péptido Aß, tiene una organización modular; la tasa de agregación puede aumentar con mutaciones al comienzo del péptido, mientras que disminuye cuando ocurren mutaciones en la región final e hidrófoba del péptido. Los investigadores también encontraron que la carga eléctrica del péptido juega un papel importante en la prevención de la agregación.
Una técnica robusta que se puede aplicar a otras enfermedades
Los investigadores también analizaron las catorce mutaciones conocidas en el péptido Aß que causan la enfermedad de Alzheimer familiar, una forma hereditaria de la enfermedad. Encontraron que las catorce mutaciones aumentan la agregación del péptido Aß. Según los autores, este es un hallazgo muy importante que sugiere que el mecanismo bioquímico observado en este trabajo es muy similar, y tal vez el mismo, al que causa la enfermedad humana.
«Estas mutaciones son extremadamente raras y se relacionan con un número relativamente pequeño de casos de enfermedad de Alzheimer. Sin embargo, algunas ocurrirán sin duda en algún individuo actualmente vivo en el planeta y, por lo tanto, debemos poder predecir las que son dañinas y que causarán la enfermedad. Esto puede ayudarnos a identificar de manera temprana, si una persona tiene probabilidades de desarrollar la enfermedad para así poder tomar medidas preventivas cuando sea posible”, concluye Benedetta Bolognesi.
Estas catorce mutaciones conocidas son menos del 4% de todas las mutaciones que pueden ocurrir en Aß. Este nuevo trabajo mide los efectos de todas las más de 350 mutaciones adicionales en Aß, identificando aquellas que aceleran la formación de agregados y, por lo tanto, las mutaciones que tienen más probabilidades de causar la enfermedad de Alzheimer.
Ahora estamos deseando construir mapas para otras proteínas que causan diferentes enfermedades neurodegenerativas como la enfermedad de Parkinson y ver que los datos de nuestro atlas se utilizan en la clínica.
Mireia Seuma, primera autora del trabajo e investigadora del IBEC.
Este proyecto es un estudio piloto para una importante colaboración internacional llamada “Atlas of Variant Effects” (https://www.varianteffect.org/) que tiene como objetivo caracterizar los efectos de cada posible mutación en el genoma humano e identificar y comprender todas las mutaciones que provocan miles de enfermedades diferentes.
Artículo de referencia: Mireia Seuma, Andre J. Faure, Marta Badia, Ben Lehner, Benedetta Bolognesi. “The genetic landscape for amyloid beta fibril nucleation accurately discriminates familial Alzheimer’s disease mutations.” eLife 2021; 10:e63364.





