El Rabdomiosarcoma es un cáncer altamente maligno que típicamente se desarrolla a partir de células musculares esqueléticas, las que están relacionadas con el movimiento muscular voluntario, y que puede surgir en diferentes partes del cuerpo. Es más frecuente en niños y representa el 5% de todos los tumores pediátricos. Los tratamientos actuales contra este tipo de cáncer incluyen quimioterapia, radiación y cirugía. Sin embargo, las tasas de supervivencia de los pacientes de alto riesgo no han mejorado en las últimas décadas, y los pacientes con recaída presentan un mal pronóstico, puesto que su respuesta a los tratamientos actuales es a menudo insuficiente para evitar el desarrollo del cáncer.
Ahora, los investigadores Clara Alcon, Albert Manzano, Josep Samitier y Joan Montero, del grupo Nanobioingeniería en IBEC, junto con investigadores de los institutos VHIR, IDIBELL y IRSJD, asociados a hospitales, publican en Cell Death & Disease, una revista del grupo editorial Nature, un estudio donde utilizan un biomarcador para saber en qué momento y de qué forma las células van a dejar de responder al tratamiento. Con los datos del biomarcador, han logrado realizar un tratamiento secuencial con dos medicamentos diferentes, a concentraciones diez veces más bajas que las habituales, y han obtenido una alta citotoxicidad, con la muerte de alrededor del 80% de las células tumorales. Esta estrategia aumenta la eficacia de los tratamientos actuales a la vez que disminuye la toxicidad inducida por la terapia.
La clave de un tratamiento eficaz: favorecer la muerte de las células cancerosas
Las terapias habitualmente empleadas contra el cáncer causan la muerte de las células cancerosas principalmente por apoptosis, un proceso de muerte celular controlado por una familia de proteínas llamadas BCL-2. Sin embargo, lo que suele ocurrir en diversos cánceres humanos y en pacientes que sufren recaídas, es que las células tumorales “escapan” de la apoptosis produciendo proteínas que inhiben este proceso, conocidas como proteínas antiapoptóticas.
Es por eso que la búsqueda de medicamentos que anulen la acción de estas proteínas antiapoptóticas representa un enfoque terapéutico prometedor para tratar pacientes de Rabdomiosarcoma de alto riesgo. En ese sentido, se han desarrollado en los últimos años medicamentos que actúan como inhibidores de las proteínas antiapoptóticas, aquellas que permiten que las células tumorales entren en apoptosis y mueran. Una de ellas se ha denominado BH3-mimético, pero hasta ahora no había protocolos para guiar su uso de manera efectiva en la clínica.
Para resolver este problema los investigadores del IBEC han utilizado un biomarcador predictivo funcional – llamado “perfil de BH3 dinámico” – para identificar adaptaciones antiapoptóticas de las células tumorales durante el tratamiento. Utilizando esta tecnología pueden determinar la sensibilidad de las células cancerosas al compuesto BH3-mimético, que aumenta la apoptosis, y superar la resistencia del Rabdomiosarcoma a la quimioterapia.
El nuevo método puede predecir cuándo las células tumorales dejarán de responder al tratamiento
En este trabajo los investigadores han estudiado el uso de BH3-miméticos para aumentar la sensibilidad del Rabdomiosarcoma a la quimioterapia e identificaron adaptaciones antiapoptóticas a terapias actualmente empleadas. Fueron capaces de predecir con días de antelación cuando las células cancerosas dejarían de responder al tratamiento.
Basándose en ese método, encontraron tres nuevas combinaciones de fármacos actualmente utilizados para tratar el Rabdomiosarcoma con inhibidores antiapoptóticos específicos (BH3-miméticos), que mataron células cancerosas sin afectar las sanas. Además, observaron que estas combinaciones, cuando se aplicaban de forma secuencial, actuaban sinérgicamente, es decir, que el efecto de las dos era más fuerte que la suma de cada una individualmente. Este es un aspecto clave del estudio, puesto que los efectos secundarios derivados de la administración de quimioterapia en niños son graves y pueden incluir infertilidad, cardiomiopatía o la aparición otros cánceres. Utilizando esta nueva metodología, el tiempo y la dosis de la administración de medicamentos se pueden optimizar para reducir estos efectos secundarios no deseados.
Utilizando nuestra técnica fuimos capaces de medir la efectividad de un tratamiento, y lo más importante, pudimos detectar adaptaciones de resistencia en células tumorales que promueven la supervivencia del cáncer.
Clara Alcon, investigadora del IBEC y primera autora del estudio.
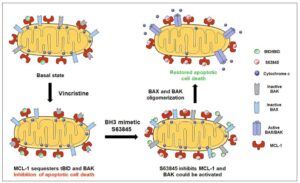
Esta estrategia fue validada in vivo en un modelo, conocido como xenógrafo, en el que células cancerosas de un paciente se implantan y se amplían en ratones que siguen desarrollando el cáncer. Esta técnica proporciona más material para ser utilizado en el laboratorio y es ventajosa en la investigación preclínica, puesto que recapitula la respuesta terapéutica de los pacientes. Utilizando esta metodología, los investigadores encontraron por ejemplo que un tratamiento secuencial con vincristina, un inductor de la apoptosis ampliamente usado para el tratamiento del cáncer, y con el MCL-1 S63845, un inhibidor de la proteína antiapoptótica MCL-1, mejora de forma sinérgica el efecto de la vincristina para tratar este tipo de cáncer tanto in vitro como in vivo.
Estas nuevas estrategias terapéuticas podrían mejorar el tratamiento de los pacientes de Rabdomiosarcoma, incluyendo los que presentan recaídas, si se guían por un biomarcador funcional predictivo efectivo, como por ejemplo un perfil de BH3 dinámico.
Joan Montero, investigador IBEC responsable del estudio.
Artículo de referencia: Clara Alcon, Albert Manzano-Muñoz, Estela Prada, Jaume Mora, Aroa Soriano, Gabriela Guillén, Soledad Gallego, Josep Roma, Josep Samitier, Alberto Villanueva, Joan Montero. Sequential combinations of chemotherapeutic agents with BH3 mimetics to treat rhabdomyosarcoma and avoid resistance. Cell Death and Disease (2020) 11:634.
Este trabajo se ha realizado en colaboración con el Laboratorio de la Biología del Desarrollo del Tumor, Instituto de Investigación San Juan de Dios; Departamento de Hematología y Oncología, Hospital San Juan de Dios; Grupo de Investigación Traslacional en cáncer en la infancia y la adolescencia, Instituto de Investigación Vall de Hebrón (VHIR); Departamento de Cirugía, Universidad Autónoma de Barcelona (UAB); Departamento de Electrónica e Ingeniería Biomédica, Universidad de Barcelona; Programa contra la Resistencia Terapéutica al Cáncer (Procuro), IDIBELL, Instituto Catalán de Oncología; Xenopat S.L., Business Bioincubator. El laboratorio de Nanobioingeniería forma parte de la red CIBER-BBN.





