L’apnea del son podria promoure el creixement tumoral en els més joves
 Un estudi publicat a l’American Journal of Respiratory and Critical Care Medicine ha revelat que l’apnea del somni podria promoure el creixement del càncer de pulmó entre els més joves.
Un estudi publicat a l’American Journal of Respiratory and Critical Care Medicine ha revelat que l’apnea del somni podria promoure el creixement del càncer de pulmó entre els més joves.
Investigadors de l’IBEC, la Universitat de Barcelona i l’Hospital Clínic mostren que, contràriament a l’esperat, l’edat pot ser un factor de protecció contra el ràpid desenvolupament tumoral induït per aquesta alteració respiratòria del somni i la seva conseqüència immediata, la hipòxia intermitent.


 Un estudi publicat a l’American Journal of Respiratory and Critical Care Medicine ha revelat que l’apnea del somni podria promoure el creixement del càncer de pulmó entre els més joves.
Un estudi publicat a l’American Journal of Respiratory and Critical Care Medicine ha revelat que l’apnea del somni podria promoure el creixement del càncer de pulmó entre els més joves.
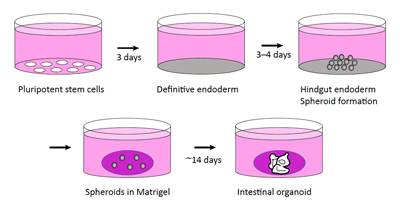 El grup de l’IBEC
El grup de l’IBEC 
 L’investigador principal de l’IBEC i professor de recerca ICREA Xavier Trepat ha publicat una ressenya a l’edició ‘Insight: The Physics of Living Systems’ de Nature Physics, en el qual tots els articles han estat co-escrits per un físic i un biòleg.
L’investigador principal de l’IBEC i professor de recerca ICREA Xavier Trepat ha publicat una ressenya a l’edició ‘Insight: The Physics of Living Systems’ de Nature Physics, en el qual tots els articles han estat co-escrits per un físic i un biòleg. 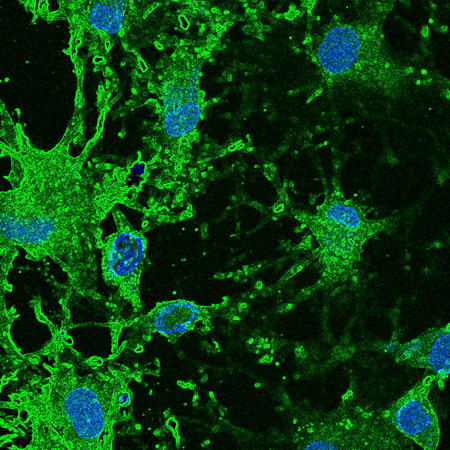
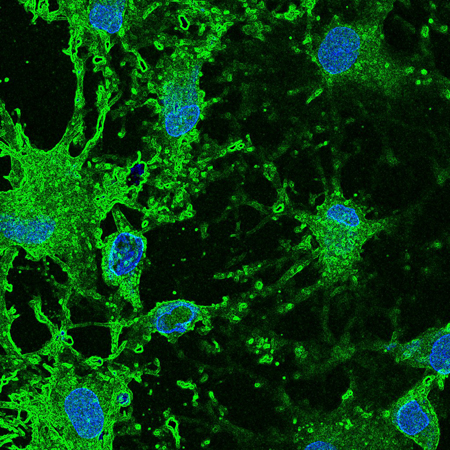 El grup de Biomaterials per a teràpies regeneratives de l’IBEC ha publicat una revisió de l’estat de l’art en biomaterials per a la curació de pell que proposa un canvi cap a una atenció més personalitzada.
El grup de Biomaterials per a teràpies regeneratives de l’IBEC ha publicat una revisió de l’estat de l’art en biomaterials per a la curació de pell que proposa un canvi cap a una atenció més personalitzada. 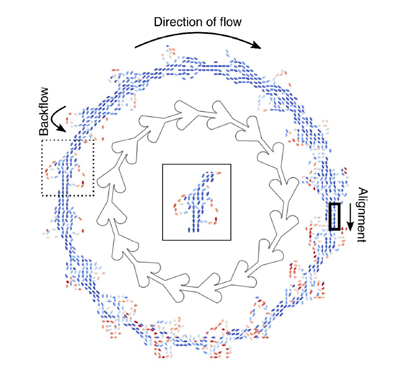
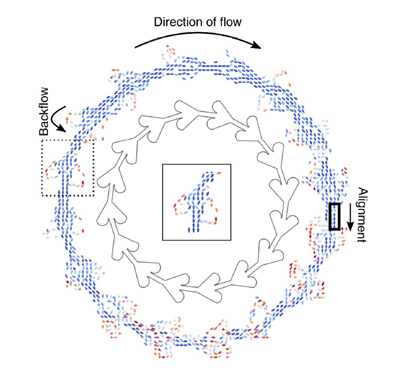 Els grups Smart-Nano-Bio-Devices i Nanobioengineering de l’IBEC s’han unit per resoldre el problema del moviment aleatori de micro i nanomotors.
Els grups Smart-Nano-Bio-Devices i Nanobioengineering de l’IBEC s’han unit per resoldre el problema del moviment aleatori de micro i nanomotors.
 Una recerca liderada pel National Graphene Institute de la Universitat de Manchester, que ha comptat amb la col·laboració de l’IBEC, revela que la capa d’aigua que cobreix totes les superfícies que ens envolten té propietats elèctriques molt diferents a l’aigua normal.
Una recerca liderada pel National Graphene Institute de la Universitat de Manchester, que ha comptat amb la col·laboració de l’IBEC, revela que la capa d’aigua que cobreix totes les superfícies que ens envolten té propietats elèctriques molt diferents a l’aigua normal.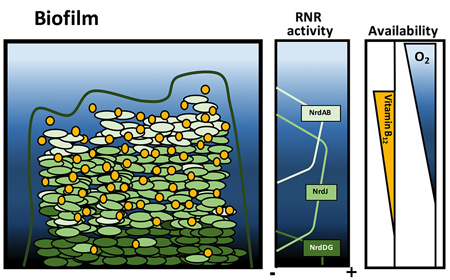
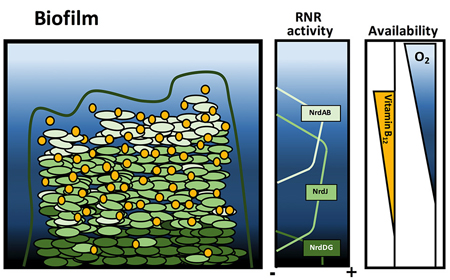 El grup de l’IBEC Bacterial infections: antimicrobial therapies ha revelat el paper essencial que exerceix una vitamina en el desenvolupament de biopel·lícules bacterianes.
El grup de l’IBEC Bacterial infections: antimicrobial therapies ha revelat el paper essencial que exerceix una vitamina en el desenvolupament de biopel·lícules bacterianes. 
 Investigadors de l’IBEC ha descobert que la divisió cel·lular que es produeix en teixits epitelials està regulada per forces mecàniques
Investigadors de l’IBEC ha descobert que la divisió cel·lular que es produeix en teixits epitelials està regulada per forces mecàniques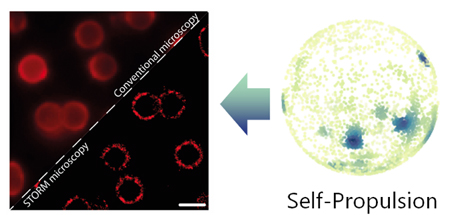
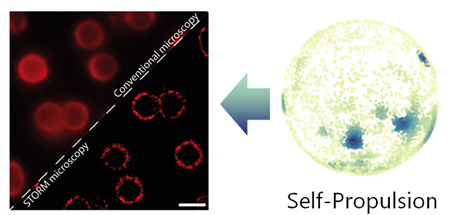 Dos grups de l’IBEC s’han associat per revelar nous coneixements que puguin impulsar el disseny de micro i nanomotors per a aplicacions de salut.
Dos grups de l’IBEC s’han associat per revelar nous coneixements que puguin impulsar el disseny de micro i nanomotors per a aplicacions de salut.
 El darrer article de l’Alberto Elosegui-Artola, el Xavier Trepat i el Pere Roca-Cusachs és portada de l’últim número de la revistaTrends in Cell Biology, de la família editorial Cell.
El darrer article de l’Alberto Elosegui-Artola, el Xavier Trepat i el Pere Roca-Cusachs és portada de l’últim número de la revistaTrends in Cell Biology, de la família editorial Cell.