Investigadores del IBEC e ISGlobal han dirigido un estudio que apunta a la agregación de proteínas como posible diana para encontrar nuevas formas de reducir la viabilidad del Plasmodium falciparum, el principal agente causante de la malaria. Al inducir la agregación proteica, observaron trastornos considerables en la homeostasis de las proteínas y una reducción significativa del crecimiento del parásito. Los resultados sitúan el control de la agregación proteica como una diana prometedora para las terapias antimaláricas.
La malaria sigue siendo una carga persistente para la salud pública mundial, y el parasito Plasmodium falciparum causa la forma más peligrosa de la enfermedad y las infecciones más letales. Su capacidad para desarrollar resistencia a los tratamientos actuales subraya la urgencia de identificar nuevas dianas moleculares.
En este contexto, un estudio reciente liderado por el grupo de investigación Nanomalaria del Instituto de Bioingeniería de Cataluña (IBEC) y el Instituto de Salud Global de Barcelona (ISGlobal), ha descubierto una potencial vulnerabilidad en P. falciparum al inducir la agregación de proteínas dentro del parásito. Los investigadores indujeron la sobreexpresión de un segmento específico de una proteína intrínsecamente desordenada, lo que afectó significativamente al crecimiento del parásito. El trabajo, publicado en la revista Frontiers in Cellular and Infection Microbiology, puede abrir la puerta a nuevas estrategias antimaláricas dirigidas a la maquinaria interna de plegamiento de proteínas del parásito.
Descubrimiento de un posible talón de Aquiles en los parásitos de la malaria
El concepto de agregación de proteínas, que se refiere a la acumulación de proteínas mal plegadas o desplegadas en grupos insolubles, ha sido fundamental en este estudio. En los seres humanos, este proceso se asocia a varias enfermedades neurodegenerativas, como el Alzheimer y el Parkinson, en las que las proteínas agregadas alteran las funciones celulares y provocan la muerte celular. La agregación de proteínas suele contrarrestarse mediante chaperonas moleculares y sistemas proteasomales que mantienen la proteostasis, un equilibrio celular esencial de síntesis, plegamiento y degradación de proteínas.
En P. falciparum, sin embargo, el escenario es particularmente intrigante. Por un lado, el parásito codifica una robusta red de proteostasis adaptada para sobrevivir a los intensos cambios metabólicos y a las condiciones de estrés que encuentra durante su ciclo vital, tanto en el interior de su vector, los mosquitos del género Anopheles, como en el huésped humano.
Al sobreexpresar un segmento desordenado de la proteína PfUT en P. falciparum, alteramos este frágil equilibrio, desencadenando estrés proteotóxico y provocando una reducción del crecimiento del parásito.
Yunuen Avalos-Padilla
Sin embargo, y contradictoriamente, las proteínas de P. falciparum son muy propensas a la agregación. A pesar de su genoma relativamente pequeño y su proteoma eficiente, la alta propensión a la agregación de proteínas en este organismo puede reflejar un compromiso evolutivo bien ajustado entre funcionalidad e inestabilidad. Esta propiedad puede conferir al parásito ventajas adaptativas específicas, como contribuir a la protección proteica o facilitar la formación de agregados relacionados con el estrés que le ayuden a sobrevivir en entornos hostiles, como la fiebre en el huésped humano y el estrés oxidativo en las células infectadas. En este sentido, posee una proporción relativamente alta de proteínas con regiones intrínsecamente desordenadas – como la proteína ubiquitina ligasa, PfUT – que suelen ser más propensas al mal plegamiento y la agregación bajo estrés.
Este complejo escenario proteómico llevó a los investigadores a explorar si un aumento inducido de una proteína muy abundante y propensa a la agregación como PfUT podría desplazar el proteoma del parásito hacia un estado de agregación que superase su maquinaria de control de la proteostasis, provocando una disminución de su viabilidad.
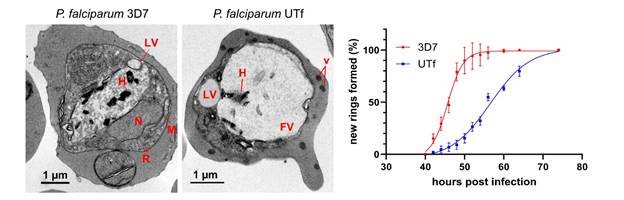
«Al sobreexpresar un segmento desordenado de PfUT en P. falciparum, alteramos este frágil equilibrio, desencadenando estrés proteotóxico y provocando una reducción del crecimiento del parásito. Sin embargo, a pesar de las alteraciones observadas en la proteostasis, los parásitos no murieron por el aumento de la agregación de esta proteína en particular, lo que demuestra su capacidad para controlar un proteoma altamente propenso a la agregación», explica Yunuen Avalos-Padilla, primera autora del trabajo. En otras palabras, al sobrecargar el sistema de proteostasis del parásito, los investigadores lograron comprometer su supervivencia, aunque el Plasmodium se pudo recuperar.
Este estudio no sólo pone de manifiesto una vulnerabilidad clave en el sistema interno de gestión de proteínas de Plasmodium falciparum, sino que también posiciona el control de la agregación de proteínas como un objetivo prometedor para la intervención antimalárica.
Xavier Fernández-Busquets
Este descubrimiento identifica un aspecto novedoso y potencialmente explotable de la biología del parásito: su susceptibilidad a las alteraciones en el control de la agregación de proteínas. Por tanto, las estrategias terapéuticas que amplifican el mal plegamiento de ciertas proteínas clave o bloquean la capacidad del parásito para responder a la agregación podrían ofrecer una nueva y eficiente línea de ataque.
En palabras de Fernàndez-Busquets, «este estudio no sólo pone de manifiesto una vulnerabilidad clave en el sistema interno de gestión de proteínas de Plasmodium falciparum, sino que también posiciona el control de la agregación de proteínas como un objetivo prometedor para la intervención antimalárica. Al profundizar en el conocimiento de los mecanismos de proteostasis del parásito, podemos abrir nuevas vías para combatir una de las enfermedades infecciosas más persistentes del mundo».
No obstante, pasar de los resultados de laboratorio a la aplicación clínica requiere más trabajo. Los estudios futuros tendrán que dilucidar las interacciones moleculares precisas implicadas y determinar si existen vulnerabilidades similares en las distintas fases de vida del parásito. Además, cualquier compuesto que se desarrolle para explotar este mecanismo deberá evaluarse cuidadosamente para garantizar su selectividad y seguridad.
Artículo de referencia:
Yunuen Avalos-Padilla, Inés Bouzón-Arnáiz, Miriam Ramírez, Claudia Camarero-Hoyos, Marc Orozco-Quer, Elsa M. Arce, Diego Muñoz-Torrero and Xavier Fernàndez-Busquets. Overexpression in Plasmodium falciparum of an intrinsically disordered protein segment of PfUT impairs the parasite’s proteostasis and reduces its growth rate. Front. Cell. Infect. Microbiol. Volume 15 – 2025. doi: 10.3389/fcimb.2025.1565814





