
Comprender las características biológicas de los biofilms, la causa de la mayoría de las infecciones bacterianas, es el primer paso para luchar contra esta pandemia silenciosa y encontrar tratamientos efectivos.
Las infecciones bacterianas son un problema de salud pública que afecta a millones de personas en todo el mundo y alrededor del 80% está asociado a biofilms, comunidades formadas por diferentes especies de microorganismos que co-colonizan tejidos humanos y dispositivos médicos. Debido a varias características biológicas, los biofilms son mucho más recalcitrantes que las infecciones bacterianas aisladas y necesitan períodos más prolongados y dosis más altas de antibióticos para ser tratados. Esta situación contribuye a incrementar la resistencia global a los antibióticos que estamos observando hoy en día en el ámbito hospitalario
En este contexto, Pseudomonas aeruginosa es una bacteria que puede coexistir e interactuar con una amplia gama de microorganismos en biofilms provocando numerosas infecciones de alto impacto clínico y que a menudo conducen a infecciones crónicas. Ahora, Eduard Torrent, líder del grupo “Infecciones bacterianas: terapias antimicrobianas” del IBEC y profesor del Departamento de Genética, Microbiología y Estadística de la Facultad de Biología de la Universidad de Barcelona (UB), y Maria del Mar Cendra, investigadora postdoctoral en su laboratorio, publican en la revista Biotechnology Advances, una revisión completa que describe aspectos clave de los biofilms de P. aeruginosa, incluyendo las principales especies de microorganismos que pueden coexistir y el impacto negativo que pueden tener en la clínica.
Biofilms de P. aeruginosa
La gran capacidad de P. aeruginosa para crecer en biofilms con hongos, virus y otras bacterias (casi nunca se encuentra infectando sola) y para colonizar dispositivos médicos y tejidos humanos es un creciente problema de salud pública mundial. Esos biofilms tienen una mayor tolerancia a los antibióticos y mayor resistencia a las respuestas de defensa del huésped. En esta revisión, los investigadores descifran la implicación de P. aeruginosa en los biofilms y abren las puertas a encontrar soluciones en un futuro próximo.
Solo con el desarrollo continuo y estrategias eficaces frente a los biofilms podemos abordar la recurrencia y la cronicidad causadas por las infecciones de biofilms de P. aeruginosa.
Eduard Torrents, líder del grupo “Infecciones bacterianas: terapias antimicrobianas” del IBEC y profesor de la UB.
P.aeruginosa interactúa con muchos virus respiratorios en infecciones crónicas, incluido el SARS-CoV-2, el agente causal de la pandemia de COVID-19. Estudios de otros investigadores han demostrado que el 7% de los pacientes hospitalizados infectados con SARS-CoV-2 padecían coinfección bacteriana, P. aeruginosa estando presente en el 12% de ellos. Además, P. aeruginosa puede colonizar dispositivos médicos como los tubos endotraqueales, utilizados en pacientes con COVID-19 que necesitan respiración asistida. Se ha encontrado formación de biofilm en el 95% de los pacientes intubados durante más de 24 h. Este tipo de biofilms, en los que P. aeruginosa es el principal agente causal, son perdurables y pueden permanecer a pesar del tratamiento con antibióticos, lo que aumenta el riesgo de infecciones respiratorias.
P. aeruginosa, junto con las bacterias Staphylococcus aureus y Streptococcus, también juega un papel protagonista en las infecciones por biofilms asociadas a la fibrosis quística (40-60% del total), un trastorno genético que afecta principalmente a los pulmones, pero también al páncreas, hígado, riñones e intestino. Además, también es un patógeno relevante en infecciones crónicas de heridas y lesiones cutáneas, y en queratitis, una infección corneal común relacionada con la formación de biofilms bacterianos sobre lentillas de contacto.
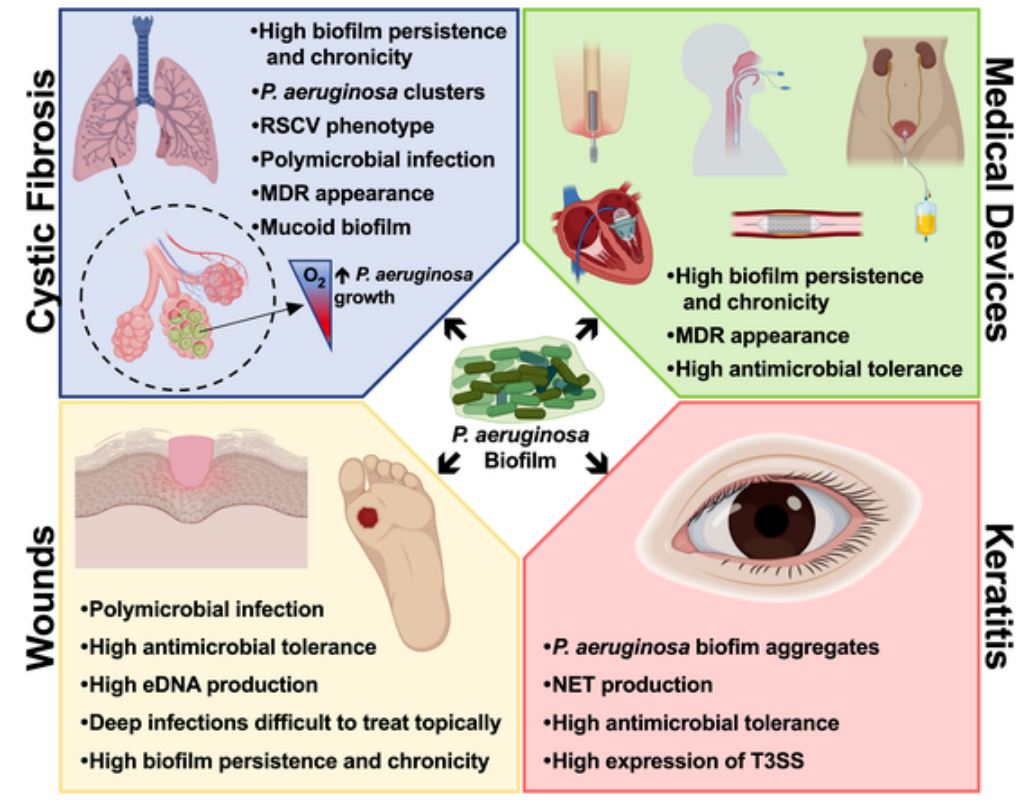
Fig 1: Principales características de los biofilms de P. aeruginosa y sus respectivas consecuencias en la progresión de infecciónes.
Todos para uno y uno para todos
Los biofilms bacterianos están formados por diferentes especies que colonizan y crecen juntas en los tejidos humanos, provocando infecciones en el tracto urinario, pulmón y riñón entre otros, y en superficies de dispositivos médicos, como prótesis articulares, válvulas cardíacas y marcapasos, implantes dentales y mamarios, suturas y catéteres. Esta amplia presencia da una idea del impacto de gran alcance de los biofilms en el ámbito clínico.
El estilo de vida gregario en el que las bacterias se protegen entre sí hace que sea extremadamente difícil luchar contra los biofilms con los enfoques clásicos utilizados contra las infecciones bacterianas individuales. Las bacterias producen sustancias extracelulares que actúan como soporte y protección para toda la comunidad. También tienen la capacidad de comunicarse entre ellas mediante un complejo sistema químico conocido como “quorum sensing” para regular de manera coordinada el crecimiento y el establecimiento del biofilm.
En conjunto, las características de los biofilms les hacen más resistentes a los antibióticos, a las tensiones externas y a las respuestas de defensa del paciente. En algunos casos, para tratar eficazmente una infección por biofilm bacteriano, la dosis de antibiótico utilizada debe multiplicarse por 1000 en comparación con una infección simple, una concentración difícil de alcanzar en pacientes sin causar toxicidad. La mayoría de las veces, las infecciones por biofilms solo pueden tratarse mediante su eliminación, lo que lo hace a menudo inasequible y conduce a un desgaste mental en los pacientes. Además, las infecciones causadas simultáneamente por diferentes especies a menudo se asocian con un peor pronóstico.
Medidas actuales y futuras para luchar contra los biofilms bacterianos
La complejidad para tratar las infecciones por biofilms bacterianos con antibióticos y la aparición de resistencias llevó al uso de nuevos enfoques antimicrobianos con el objetivo de inhibir la adhesión de las bacterias a las superficies, desagregar y dispersarlas. Estos inhiben la producción de ciertos componentes que promueven la formación de biofilms y aumentan la difusión de antibióticos dentro de los mismos. Por ejemplo, el uso de inhibidores de detección de “quorum sensing”, compuestos que degradan el biofilm y péptidos antimicrobianos dirigidos a moléculas específicas de P. aeruginosa son las estrategias más utilizadas. Los sistemas de administración de fármacos obtenidos por bioingeniería son una buena alternativa para liberar agentes terapéuticos dentro del biofilm, aumentando la especificidad y reduciendo la toxicidad para el paciente.
Históricamente, las infecciones bacterianas se han estudiado in vitro utilizando especies individuales, sin tener en cuenta los biofilms. Sin embargo, ahora sabemos que los biofilms son la principal forma de crecimiento bacteriano en la naturaleza y la causa de la mayoría de las infecciones bacterianas humanas. “El verdadero desafío ahora es recrear modelos en el laboratorio capaces de reproducir las características biológicas y fisiológicas de los biofilms bacterianos”, concluye Maria del Mar Cendra, primera autora del trabajo.
Artículo de referencia: Maria del Mar Cendra and Eduard Torrents. Pseudomonas aeruginosa biofilms and their partners in crime. Biotechnology Advances (2021), 49, article 107734.





