Se trata de asembloides, organoides micrométricos formados por la unión de organoides de riñón con organoides vasculares en 3D. Estos pequeños sistemas de cultivo son útiles para el modelado de enfermedades y el cribado de fármacos. El estudio, liderado por el IBEC, describe un abordaje que no se había probado antes.
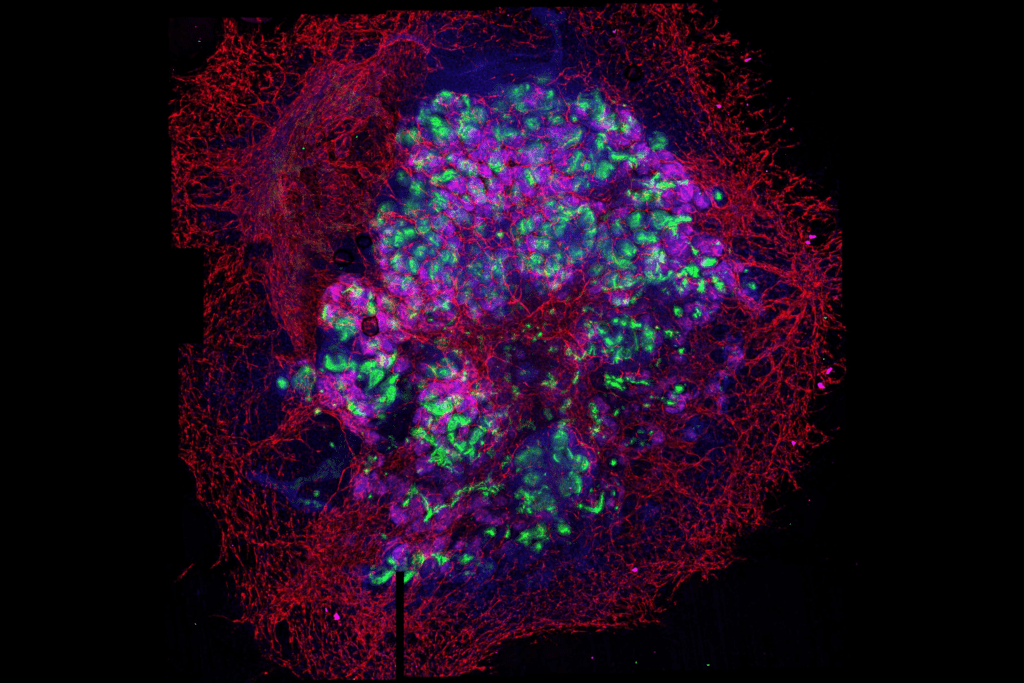
Un estudio liderado por el Instituto de Bioingeniería de Cataluña (IBEC) describe un nuevo abordaje para producir mini riñones en el laboratorio que replican una vasculatura compleja, similar en algunas características a la de los riñones humanos. Estos «asembloides» se crean mediante la unión de organoides de riñón en 3D con organoides endoteliales.
Los organoides son estructuras tridimensionales cultivadas in vitro que imitan las funciones de los órganos y son una herramienta prometedora para el modelado de enfermedades y el cribado de fármacos. Sin embargo, estos pequeños órganos a menudo carecen de sistemas nervioso, inmunológico o vascular debido a su complejidad.
Cuando estos dos tipos de organoides están juntos, inician un proceso de interacción en apenas tres horas. El resultado de este procedimiento es verdaderamente espectacular.
Núria Montserrat Pulido
Reproducir en el laboratorio el complejo sistema de vascularización de los riñones, un tejido altamente irrigado, ha sido un desafío para los científicos durante más de una década. Ahora, este trabajo publicado en la prestigiosa revista científica Advanced Materials, describe una aproximación que no se había probado antes:
“Hemos ensamblado organoides de riñón con organoides vasculares. Para llevar a cabo con éxito este proceso, es esencial identificar el momento idóneo para unirlos, teniendo en cuenta el momento de desarrollo de cada uno de los organoides”, explica Núria Montserrat Pulido, profesora de investigación ICREA, investigadora principal del IBEC y líder del estudio. “Cuando estos dos tipos de organoides están juntos, inician un proceso de interacción en apenas tres horas. El resultado de este procedimiento es verdaderamente espectacular”, destaca.
Estos hallazgos no solo proporcionan información valiosa sobre el desarrollo de los organoides renales, sino que también sientan las bases para diseñar nuevos procedimientos de vascularización de estos organoides. Esto podría tener aplicaciones en trasplantes de organoides en entornos clínicos y en investigaciones sobre disfunciones vasculares en enfermedades humanas.
“Necesitamos tener este sistema vascular en nuestros organoides si queremos modelar patologías sistémicas que afectan al riñón a través del torrente sanguíneo, como puede ser una enfermedad autoinmune o una diabetes, por ejemplo. Creemos, además, que el abordaje que hemos utilizado en este estudio se podría aplicar también a otros modelos de organoide.”, detalla Elena Garreta Bahima, investigadora en el grupo de Montserrat en el IBEC y primera autora del estudio.
El siguiente paso, comenta Montserrat, será introducir estos organoides vascularizados en un chip microfluídico para poder hacer estudios todavía más especializados a fin de mimetizar condiciones que acontecen en enfermedades complejas así cómo permitir la conexión vascular con otros organoides, como los organoides cardiacos, trabajo que hoy en día están desarrollando en el laboratorio en IBEC.
Imprimir con células
El equipo de investigación ya había visto en estudios anteriores que los organoides de riñón que generaban contenían un componente vascular: células de endotelio, que son las que acaban dando lugar a los vasos sanguíneos. Utilizando tejido renal de origen porcino o humano, crearon un hidrogel biocompatible, que podría ser utilizado como tinta para impresión 3D.
Necesitamos tener este sistema vascular en nuestros organoides si queremos modelar patologías sistémicas que afectan al riñón a través del torrente sanguíneo, como puede ser una enfermedad autoinmune o una diabetes, por ejemplo.
Elena Garreta Bahima
Con esta base, decidieron simplificar el sistema para hacerlo más accesible y económico. De entre todas las proteínas que conforman el hidrogel, seleccionaron el colágeno I, una de las proteínas más abundantes en la matriz extracelular del tejido renal, y generaron un gel biocompatible con el que validaron sus resultados experimentales.
Este trabajo representa un hito significativo en el campo de las terapias emergentes y avanzadas, una de las principales áreas de investigación del IBEC. Estas terapias son tratamientos médicos innovadores que emplean tecnologías de vanguardia para abordar enfermedades y condiciones complejas.
El estudio además ha aglutinado a investigadores de otros centros que forman parte de la Plataforma Nacional de Biomodelos y Biobancos del Instituto de Salud Carlos III (PISCIII-BB), poniendo en relieve la importancia de la colaboración en red para la definición de soluciones en biomedicina basadas en bioingeniería. Esta Plataforma, coordinada por Núria Montserrat, subdirectora de iniciativas de traslación clínica del IBEC, proporciona servicios de alto nivel científico y tecnológico al integrar y coordinar las actividades de todas sus unidades en respuesta a las necesidades del Sistema Nacional de Salud, además, maneja más de 500,000 muestras biológicas y datos clínicos relacionados.
Además del IBEC, participaron en el estudio el Centro de Investigación Médica Aplicada (CIMA) de la Universidad de Navarra, el Instituto de Investigación Biomédica de A Coruña (INIBIC), el centro tecnológico Leartiker (País Vasco), el Hospital Clínic de Barcelona y el Hospital General Universitario Gregorio Marañón (Madrid).
Referenced Article:
Elena Garreta, Daniel Moya-Rull, Andrés Marco, Gaia Amato, Asier Ullate-Agote, Carolina Tarantino, Maria Gallo, David Esporrín-Ubieto, Alberto Centeno, Amaia Vilas-Zornoza, Rafael Mestre, María Kalil, Izar Gorroñogoitia, Ane Miren Zaldua, Samuel Sánchez, Laura Izquierdo Reyes, María Eugenia Fernández-Santos, Felipe Prosper, and Nuria Montserrat. Natural Hydrogels Support Kidney Organoid Generation and Promote In Vitro Angiogenesis. Advanced Materials (2024). DOI: https://doi.org/10.1002/adma.202400306





