En una colaboración internacional, investigadores liderados por Nuria Montserrat, Profesora de Investigación ICREA en el IBEC, han generado minirriñones humanos que simulan el riñón de una persona con diabetes en las etapas iniciales de la enfermedad. Estos minirriñones diabéticos abren las puertas a estudiar, entre otros, la relación entre la diabetes y la COVID-19.
Hace dos años que miles de científicos y médicos de todo el mundo trabajan para entender cómo se desarrolla la COVID-19 y qué relación tiene con otro tipo de enfermedades. Diversos estudios han señalado, que las personas que sufrían diabetes eran más propensas a desarrollar una COVID-19 severa, así como que más del 20% de los pacientes hospitalizados por COVID-19 sufrían daño renal agudo. Sin embargo, hasta la fecha, se desconocía cual era el factor causal que originaba que esto sucediera.

Ahora, un equipo internacional liderado por Nuria Montserrat, profesora de investigación ICREA en el Instituto de Bioingeniería de Cataluña (IBEC) e investigadora principal del grupo “Pluripotencia para la regeneración de órganos”, en colaboración, entre otros, con investigadores de la Universidad de Florida, el Life Sciences Institute de la Universidad de British Columbia en Canadá, Karolinska Institute y Karolinska University Hospital en Suecia, ha utilizado la bioingeniería para desarrollar minirriñones que simulan el riñón de pacientes en las fases iniciales de la diabetes.
Nuestro modelo de organoide renal diabético nos ha permitido observar que los minirriñones diabéticos, con mayor número de receptores ACE2, presentan una mayor susceptibilidad a la infección viral.
Elena Garreta, investigadora en el IBEC y primera coautora del estudio
En el trabajo, Montserrat también ha contado con la colaboración de investigadores españoles de la Clínica CIMA y la Universidad de Navarra, el Hospital Clínic de Barcelona, el Hospital de la Santa Creu i Sant Pau en Barcelona y de la Universidad de Barcelona. Este estudio ha recibido financiación del Instituto de Salud Carlos III (ISCIII), a través de las ayudas FONDO COVID19: Convocatoria Financiación Extraordinaria de Proyectos de Investigación sobre el SARS-CoV1 y la enfermedad Covid-19 y PLATAFORMA ISCIII BIOBANCOS Y BIOMODELOS: Plataformas ISCIII de apoyo a la I+D+I en Biomedicina y Ciencias de la Salud.
Esta es la primera vez que los investigadores utilizan organoides de riñón para entender las primeras fases de la diabetes en este órgano.
Con la finalidad de demostrar que el receptor ACE2 tiene un papel esencial para la infección de SARS-CoV-2 en el riñón, los investigadores también generaron, mediante ingeniería genética, organoides defectivos para otros receptores descritos hasta la fecha como “puertas de entrada” para el virus. Esta fase del estudio se realizó con financiación de las Ayudas Fundación BBVA a equipos de investigación científica SARS-CoV-2 y COVID-19.
El trabajo ha utilizado, además, muestras de pacientes, poniendo en relieve el papel del metabolismo energético en la infección por SARS-CoV-2. Estos hallazgos abren la puerta a la identificación de nuevas intervenciones terapéuticas para tratar la COVID-19. Este estudio rompedor se acaba de publicar en la prestigiosa revista Cell Metabolism.
Los minirriñones diabéticos tienen más puertas de entrada para el SARS-CoV-2
Es absolutamente imperativo comprender los mecanismos moleculares que subyacen a una COVID-19 más grave en pacientes con diabetes y otras comorbilidades metabólicas. El desarrollo de un organóide de riñón diabético es un gran paso hacia la disección experimental de cómo los cambios metabólicos pueden afectar las infecciones por SARS-CoV-2. Los datos demuestran nuevamente que ACE2 es el receptor esencial para el SARS-CoV-2 incluso en condiciones de comorbilidad.
Josef Penninger, Instituto de Biotecnología Molecular de la Academia Austríaca de Ciencias
Para crear minirriñones con las mismas características celulares, y las mismas alteraciones metabólicas que las que se encuentran en los riñones de una persona diabética en la fase inicial de la enfermedad, los investigadores desarrollaron minirriñones en el laboratorio a partir de células madre humanas pluripotentes que fueron sometidos a condiciones de cultivo en el laboratorio con el fin de reproducir el entorno diabético.
Posteriormente, utilizando diferentes técnicas de biología molecular, como la edición genética, los investigadores observaron que, en los minirriñones diabéticos, la abundancia de receptor ACE2 era la que determinaba la susceptibilidad a la infección viral, estableciendo una relación causal entre la diabetes y la presencia de uno de los receptores determinantes en la infección por SARS-CoV-2.
Además, empleando técnicas punteras como la secuenciación de RNA, los investigadores identificaron que los minirriñones diabéticos poseen una firma metabólica que podría explicar por qué los minirriñones diabéticos se infectan más.
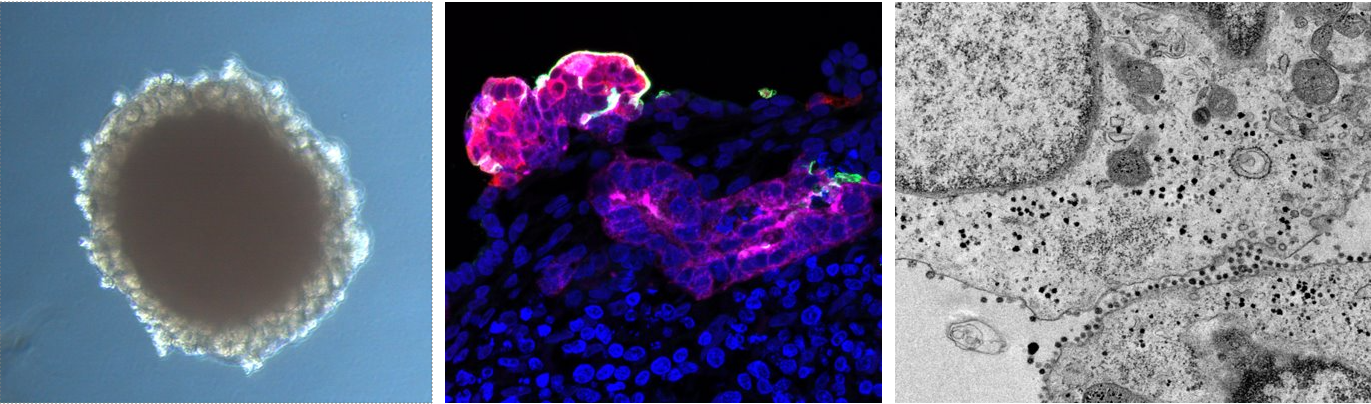
Imagen de microscopía óptica de un organoide de riñón generado a partir de células madre pluripotentes humanas [imagen de la izquierda]. Detalle de una estructura tubular proximal (magenta) de un organoide renal infectado con SARS-CoV-2, que muestra células positivas para ACE2 (verde) y células infectadas con SARS-CoV-2 (rojo) [imagen central]. Imagen de microscopía electrónica de transmisión que muestra un detalle de células del organoide infectadas con SARS-CoV-2 [imagen de la derecha].
La diabetes aumenta la susceptibilidad a la infección por SARS-CoV-2 en células de pacientes
Este hallazgo arroja luz sobre un mecanismo potencial detrás de los casos más graves de pacientes diabéticos. Esta tecnología mejorará nuestra capacidad para investigar cómo el virus interactúa con diferentes órganos del cuerpo humano.
Ali Mirazimi, profesor adjunto en Karolinska Institutet
Para verificar si los resultados obtenidos con los minirriñones se observaban también en el órgano nativo, los investigadores analizaron células renales de pacientes con diabetes y de individuos sin diabetes. Los datos demostraron que las células renales de pacientes diabéticos, del mismo modo que lo que ocurre en los minirriñones, presentaban más receptores ACE2 y sufrían susceptibilidad a la infección por SARS-CoV-2. A fin de ahondar en los mecanismos que pueden explicar tales observaciones, los investigadores utilizaron un compuesto que modula el estado metabólico de las células y comprobaron que el tratamiento disminuía la infección viral.
Hemos demostrado que el virus SARS-CoV-2 es capaz de infectar directamente las células de túbulo proximal aisladas del riñón humano, y que la diabetes hace que estas células sean más propensas a la infección.
Megan Stanifer, investigadora de la Universidad de Florida y primera coautora del estudio
Este nuevo modelo de minirriñón diabético abrirá las puertas a estudiar el papel de otras enfermedades llamadas “comórbidas”, como la hipertensión, en el desarrollo de la COVID-19 y otras patologías complejas.
Esta investigación ha sido apoyada en parte por el Instituto de Salud Carlos III y la Fundación Banco Bilbao Vizcaya a través de fondos de emergencia enfocados en acelerar el desarrollo, prueba e implementación de medidas para hacer frente al brote de COVID-19.
Nuria Montserrat es miembro del Centro de Investigación Biomédica en Red – Bioingeniería, Biomateriales y Nanomedicina (CIBER- BBN).
Artículo de referencia: Elena Garreta, Patricia Prado, Megan Stanifer, Vanessa Monteil, Andrés Marco, Asier Ullate-Agote, Daniel Moya-Rull, Amaia Vilas-Zornoza, Carolina Tarantino, Juan Pablo Romero, Gustav Jonsson, Roger Oria, Alexandra Leopoldi, Astrid Hagelkruys, Maria Gallo, Federico González, Pere Domingo-Pedrol, Aleix Gavaldà, Carmen Hurtado del Pozo, Omar Hasan Ali, Pedro Ventura-Aguiar, Josep María Campistol, Felipe Prosper, Ali Mirazimi, Steeve Boulant, Josef M. Penninger, Nuria Montserrat. A diabetic milieu increases ACE2 expression and cellular susceptibility to SARS-CoV-2 infections in human kidney organoids and patient cells. Cell Metabolism. 2022.





