Investigadores del Instituto de Bioingeniería de Cataluña (IBEC) han elaborado el atlas más completo hasta la fecha con las mutaciones genéticas que causan la formación de fibrillas de amiloide BETA, una proteína que está detrás de la enfermedad de Alzhéimer. El estudio, liderado por la investigadora del IBEC, Benedetta Bolognesi, en colaboración con el grupo de Bel Lehner en el Centro de Regulación Genómica (CRG), ha sido publicado en la prestigiosa revista científica Nature Communications.
Las fibrillas de amiloide son agregados de proteínas que se acumulan alrededor de las células, sin que el organismo consiga descomponerlas. Su presencia y proceso de formación parecen ser la causa de más de 50 enfermedades humanas, incluidas la enfermedad de Alzheimer, la enfermedad de Parkinson, la demencia frontotemporal, la esclerosis lateral amiotrófica (ELA) y la diabetes tipo II.
Los investigadores ya han conseguido descubrir la estructura de muchas fibrillas de amiloide. Sin embargo, el mecanismo por el cual se forman, conocido como reacción de nucleación, sigue siendo un misterio. Entender este mecanismo es fundamental si se quieren prevenir algunas de las principales patologías que afectan a nuestra sociedad.
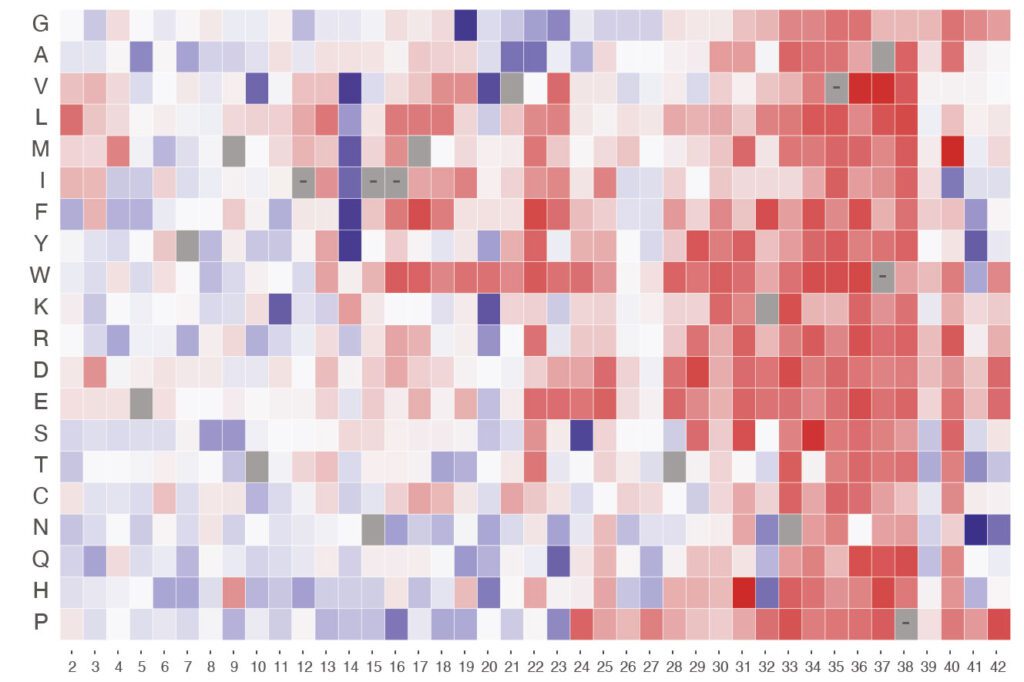
Con el escaneo mutacional profundo, una técnica de análisis celular de alto rendimiento, se consiguen caracterizar miles de mutaciones genéticas que conducen a la agregación de la proteína amiloide. Hasta ahora las técnicas de exploración de mutaciones profundas tienden a observar solo sustituciones (mutaciones en las que un bloque de construcción de ADN reemplaza a otro), e ignorar, en gran medida, otros tipos como las inserciones (mutaciones donde se añade un bloque de construcción) o las deleciones (mutaciones en las que se elimina un bloque de construcción) a pesar de que ambos mecanismos pueden ser determinantes para la acumulación de amiloide.
Mireia Seuma, investigadora del grupo de Benedetta Bolognesi en el IBEC, ha logrado desarrollar un atlas completo que compara los múltiples tipos de mutaciones y evalúa su papel en la formación de fibrillas de amiloide. Su trabajo se publicó recientemente en la prestigiosa revista científica, Nature Communications.
Mutaciones que enferman
El estudio en cuestión analizó un péptido de 42 aminoácidos, donde se identificaron 307 mutaciones que aceleran la acumulación de amiloide, un 10 % del total de las mutaciones detectadas, entre las que se encontraban muchas que no correspondían a sustituciones, sino a alteraciones del tipo inserción y deleción. Por otro lado, el elevado número de mutaciones identificadas en este péptido tan corto pone de manifiesto la enorme diversidad de variaciones que se pueden dar en el genoma humano. Estas mutaciones pueden resultar o no en enfermedad, resaltando la necesidad de saber qué impacto tienen en la nucleación de amiloide.
Además, los investigadores observaron que el 87 % de las mutaciones con probabilidad de ser patogénicas se encuentran en un extremo específico del péptido, conocido como N-terminal. Los truncamientos en esta región resultaron ser especialmente eficaces acelerando la nucleación y se prevé, por tanto, que esta región juegue un gran papel en el desarrollo del alzhéimer.
En su conjunto, este trabajo proporciona una guía integral para la interpretación clínica futura de las mutaciones y resulta en una herramienta muy útil para aquellos investigadores que realizan investigaciones básicas y clínicas sobre todos los trastornos que se esconden detrás de los agregados de amiloide.
Artículo referenciado: Seuma, M., Lehner, B. & Bolognesi, B. An atlas of amyloid aggregation: the impact of substitutions, insertions, deletions and truncations on amyloid beta fibril nucleation. Nat Commun 13, 7084 (2022). https://doi.org/10.1038/s41467-022-34742-3





